机构名称:
¥ 1.0
可以在生物疗法生产过程中保留宿主细胞DNA,这构成了将癌基因和/或其他有问题的遗传物质转移到最终药物中的风险。为了最大程度地降低这种风险,监管机构将允许限制设置在10-100 pg/剂量之间,具体取决于所用的细胞系和给药方案。USP一般章<509>“残留DNA测试”建议将基于探针的DNA定量用作经过验证的方法,用于测试在大肠杆菌(E. coli)或中国仓鼠输卵管(CHO)细胞系中产生的重组治疗产品,以确保更好的敏感性和准确性。
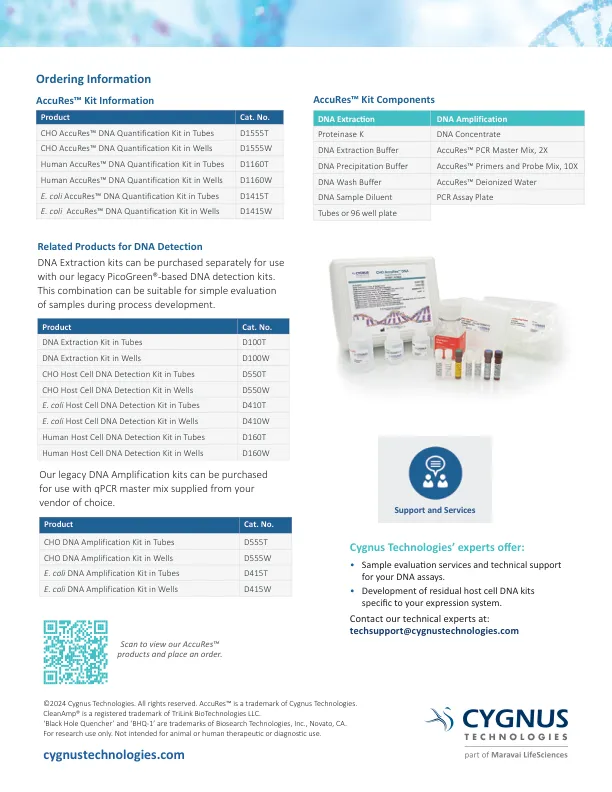
Accure™宿主细胞DNA定量试剂盒