XiaoMi-AI文件搜索系统
World File Search System受控释放杂志 - -ORCA - 卡迪夫大学
视网膜疾病是导致失明的主要原因,会导致视网膜神经元不可逆的退化和死亡。视网膜神经节细胞 (RGC) 就是这样一种细胞类型,它通过构成视神经的轴突将视网膜与大脑的其他部分连接起来,也是青光眼和外伤性视神经病变中主要的致死细胞。迄今为止,人们已经研究了不同的治疗策略来保护 RGC 免于死亡并保留视力,但目前可用的策略仅限于通过降低眼压来治疗神经元的丢失。这些研究发现,药物向 RGC 的递送是一个主要障碍,这在很大程度上是由于药物稳定性、靶向作用时间短、递送效率低以及不良的脱靶效应。因此,需要一种能够解决这些问题的递送系统,以确保候选治疗材料的最大效益。细胞外囊泡 (EV) 是一种由所有细胞释放的纳米载体,是一种包裹 RNA、蛋白质和脂质的脂质膜。由于这些囊泡能够自然地在细胞间运送这些封装的化合物,从而实现信息传递,因此它们或许具有应用价值,并为克服视网膜药物输送中的障碍(包括药物稳定性、药物分子量、视网膜屏障以及药物不良反应)提供机会。本文,我们总结了囊泡药物输送系统的潜力,探讨了其优势以及靶向视网膜神经节细胞(RGC)的潜在应用。
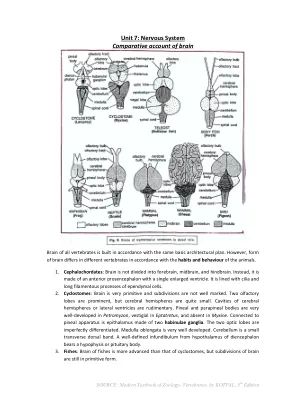
第七单元:神经系统大脑的比较说明
脑叶明显,但大脑半球很小。大脑半球腔或侧脑室发育不全。Petromyzon 的松果体和旁松果体非常发达,Eptatretus 的松果体和旁松果体退化,Myxine 的松果体和旁松果体缺失。与松果体相连的是由两个缰核神经节组成的上丘脑。两个视叶分化不完全。延髓发育良好。小脑是一条小的横向背带。间脑下丘脑的明确漏斗带有垂体或脑下垂体。3. 鱼类:鱼类的大脑比圆口动物的大脑更先进,但大脑的细分
孔隙尺度成像研究
绿色氢气是在高峰生产期间由剩余电力产生的,可以注入地下储层并在高需求期间回收。在本研究中,X射线断层扫描技术用于检查重复注入和提取氢气所导致的滞后现象。进行了非稳态实验以评估排水和吸液循环后氢气和盐水的分布:注入停止后立即拍摄流体孔隙空间结构的图像,并在等待16小时无流动后拍摄。使用长度为60毫米、直径为12.8毫米的Bentheimer砂岩样品,在环境温度和1 MPa的孔隙压力下注入氢气。在三个注气和注水循环中,气体流速从2毫升/分钟降低到0.08毫升/分钟,而盐水注入速率保持不变。结果表明,由于溶解在盐水中的气体扩散,存在毛细管压力滞后现象和氢通过奥斯特瓦尔德熟化迁移。这些现象是通过分析界面曲率、面积、连通性和孔隙占有率来表征的。氢气倾向于驻留在较大的孔隙空间中,这与亲水条件一致。流动停止 16 小时后,氢气聚集成较大的神经节,一个大型连通神经节占据了体积的主导地位。此外,欧拉特征在 16 小时后下降,表明连通性有所改善。这项研究意味着,奥斯特瓦尔德熟化(溶解气体的质量输送)导致的滞后现象更少,连通性更好,而忽略这一影响的假设则不然,就像在评估碳氢化合物流动和捕集时所做的那样。
“FA 患者 iPSC 衍生的视网膜、感觉和皮质
方法” 首席研究员:Vania Broccoli 博士 - CNR-米兰神经科学研究所 - IRCCS Ospedale San Raffaele,米兰 弗里德赖希共济失调 (FA) 是一种遗传性神经退行性疾病,导致步态和肢体进行性共济失调、构音障碍、腱反射丧失、锥体征和脊柱侧弯,并伴有心肌病和糖尿病。在某些情况下,患者会出现听力障碍和因视神经萎缩导致的视力严重丧失。关于这种疾病病理机制的大部分研究都集中在小脑和背神经节感觉神经元的退化。人们对视觉功能障碍和视网膜神经元退化的根本原因知之甚少。 我们的小组从 2 名患有中度或重度 AF 神经症状的患者体内生成了重编程干细胞 (iPSC),这 2 名患者分别因 Frataxin 基因中 GAA 性状的短暂或较大扩增而引起。在这个项目中,iPSC 细胞将分化为视网膜、感觉背神经节和大脑皮层的神经元,以研究细胞和线粒体的病理变化。通过比较分析,我们可以了解不同神经元类别中病理过程的进展和动态,这些神经元类别对 Frataxin 基因的失活更敏感(背神经节感觉神经元和视网膜神经元)或更抗性(大脑皮层神经元)。该项目的第二部分旨在利用 Cas9 蛋白生成“基因编辑”系统,目的是通过表观遗传机制重新激活沉默的 Frataxin 基因。通过这种方式,可以去除沉默基因的染色质修饰,诱导其启动子的重新激活和基因的重新表达。这种策略的优势在于,它能够以自身水平的表达激活内源基因,从而避免传统基因治疗方法中可能出现的基因过度表达引起的副作用。该系统的有效性将通过在患者成纤维细胞和疾病小鼠模型中重新激活 Frataxin 基因的能力来评估。还将研究 Frataxin 重新激活是否能够恢复以及在多大程度上恢复患者 iPSC 中存在的细胞和线粒体缺陷。该项目旨在通过使用患者干细胞生成受疾病不同影响的各类神经元,获得有关 FA 病理机制的新知识。此外,还将开发新的分子工具,可用于重新激活疾病中沉默的 Frataxin 基因,从而成为 AF 的新精准医疗治疗选择。 Tipo Ricerca:工作室预临床 Costo globale del Progetto 320.000 €,持续时间 2 anni(2022 年 4 月 – 2024 年 4 月)
自有权力的纳米结构压电丝作为新的耳蜗植入物的高级传感器
到2050年,预计全球超过6%的全球人口的25亿个人将受到听力损失的直接影响,这使其成为最普遍的残疾之一。[1]在听力障碍中,感觉神经听力损失(SNHL)现在影响全球60岁以上的25%的人[2],大多数情况是不可逆的,因为毛细胞无法再生。[3]听力由听觉器官进行,由声音和感觉系统组成。在内耳中,毛细胞通过声波在基底膜(BM)上引起的振动模式转导成生物信号,这些生物信号被周围神经树突和沿着螺旋神经节神经元沿着大脑的螺旋杆所吸引,并在其上引起声音和言论的每日。[4,5]
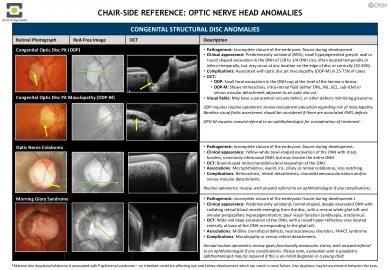
视神经乳头异常
视神经萎缩是用来描述视网膜神经节细胞轴突受损或退化的术语,导致视神经外观苍白或灰白色或杯状,表明神经组织损失。视盘边缘也会失去健康神经所见的“柔软”外观,变得更加明显。视神经萎缩的原因包括:1. 原发性视神经萎缩:发生时没有视盘肿胀。原因包括毒性/营养性、压迫性或遗传性原因以及球后视神经炎。2. 继发性视神经萎缩:指视盘肿胀后视网膜轴突受损。常见原因包括视乳头水肿、视神经炎和前部缺血性视神经病变(请参阅“视盘升高”参考资料)。 3. 逆行性变性:皮质病变导致解剖学上相连的视网膜神经纤维受损,导致视盘呈扇形或弥漫性苍白,伴有视网膜神经纤维层和神经节细胞变薄。长期病例还可能出现视盘杯状变性(请参阅本系列中的“视野”参考)。 4. 连续性视神经萎缩:与影响视网膜或其血液供应的疾病有关。这种萎缩形式从视网膜病因通过轴突组织延伸到视神经。潜在病因可能包括视网膜色素变性、血管炎、视网膜坏死、视网膜炎或之前的视网膜光凝术。 5. 青光眼:一种进行性视神经病变。青光眼的主要临床特征是视神经头和视网膜神经纤维层的特征性变化、一致的视野缺损和随时间推移的进展(见下文示例)。上面列出的许多视神经萎缩的原因可能与青光眼相似,从而使其成为排除性诊断。
糖尿病性视网膜病的小鼠中星状爆炸性细胞的原始研究变化
背景:神经退行性疾病,例如糖尿病性视网膜病(DR)和青光眼,诱导视网膜神经元丧失。乙酰胆碱 - 含有胆碱能神经元(称为Starburst amacrine细胞(SAC))在视网膜中精确的神经元活性的产生中起关键作用,位于内部核层(INL,常规)和神经节细胞(常规)和神经节细胞(GCL,位移)中。方法:本研究研究了链蛋白酶(STZ)诱导的糖尿病和胰岛素缺陷C57BL/6-TG(PH1-SIRNA胰岛素/CMV-HIDE)/KORL(IDCK)小鼠的糖尿病(STZ)诱导的糖尿病和胰岛素缺陷的糖尿病和胰岛素缺陷的囊损失和形态变化。SAC是通过抗胆碱乙酰转移酶(CHAT)抗体定位的免疫细胞化学定位的,在对照组中,INL和GCL中的聊天标记的细胞在整个垂直子午线沿整个垂直子午线进行计数,并使用常规荧光或共聚物显微镜在整个安装式视网膜中进行计数。结果:与对照组相比,STZ诱导的糖尿病小鼠视网膜中的CHAT-免疫反应性(IR)神经元在4-6周时降低了8.34%,42周时42周下降了14.89%。在20周大的IDCK小鼠视网膜中的局部CHAT-IR神经元计数比年龄匹配的对照小鼠低16.80%。细胞体的变形和聚集。单细胞注射实验揭示了DR CHAT-IR神经元中树突分支的损失和变形。所有CHAT-IR神经元均表达钙结合蛋白钙蛋白素,而没有与Calbindin-D28K或Parvalbumin共定位的CHAT-IR神经元。结论:我们的结果表明,CHAT-IR神经元丧失和变形的神经退行性作用可以为未来研究该疾病提供参考。
中脑多巴胺通过脑-身体回路驱动脾脏免疫 Adithya Gopinath 1,2 *、Alfonso Apicella 3、Aidan Smith 1、Alice Bertero
美国 5- 美国佛罗里达州盖恩斯维尔佛罗里达大学生理科学系 6- 美国佛罗里达州盖恩斯维尔佛罗里达大学药理学和治疗学系 资金:这项工作得到了 NIH 对 Habibeh Khoshbouei (HK) 的资助:R01NS071122- 07A1 (给 HK)、R01DA026947-10、美国国立卫生研究院主任办公室拨款 1S10OD020026-01 (给 H. K) R01DA058143-02 (给 HK)、R21NS133384-01 (给 HK)、Evelyn F. 和 William L. McKnight 脑研究所的 Gator Neuroscholars 计划 (给 AG) 以及 Karen Toffler 慈善信托基金 (给 AG)。摘要众所周知,中脑多巴胺神经元影响中枢神经系统功能,但越来越多的证据表明它们对外周免疫系统有影响。我们在此证明,中脑多巴胺神经元通过多突触通路从背迷走神经复合体 (DVC) 到腹腔神经节形成到脾脏的回路。中脑多巴胺神经元调节表达 D1 样和 D2 样多巴胺受体的 DVC 神经元的活动。中脑多巴胺神经元的体内激活会诱导 DVC 中的多巴胺释放,并增加 DVC 和腹腔神经节中的即刻早期基因表达,表明神经元活动增强。激活这个中脑至脾脏回路可减轻脾脏重量并减少幼稚 CD4 + T 细胞群,而不会影响总 T 细胞数量。这些发现揭示了一条功能性的中脑- DVC-腹腔神经节-脾脏通路,中脑多巴胺神经元通过该通路调节脾脏免疫。这些对免疫系统神经调节的新见解对于涉及多巴胺神经传递改变的疾病具有重要意义,并有望成为免疫治疗干预的潜在靶点。简介虽然中脑多巴胺神经元在中枢和外周调节中起着关键作用,但将它们与外周免疫器官连接起来的精确回路仍然很大程度上未定义。虽然在揭示身体与大脑之间的通讯方面已经取得了实质性进展 1 ,但反向通路(大脑如何影响外周器官,特别是通过多巴胺信号传导)仍不清楚。新出现的证据强调了大脑对外周系统的重要影响,特别是在神经免疫相互作用的背景下。例如,Zhu 及其同事 2 发现了中枢神经系统疼痛处理与脾脏免疫之间的功能联系,这表明参与免疫调节的神经通路远远超出了大脑的直接环境,影响着脾脏等关键器官。这些发现意味着中脑多巴胺能神经元可能在协调外周免疫反应中发挥着以前未曾发现的作用。在帕金森病 (PD) 中,中脑多巴胺神经元的退化与外周免疫功能障碍的变化密切相关,据信
鼻内 CRMP2-Ubc9 抑制剂调节 NaV1.7 以...
感觉神经元中电压门控钠 NaV 1.7 通道失调会导致慢性疼痛,包括三叉神经性疼痛。我们之前报告过,慢性疼痛部分是由于塌陷反应介质蛋白 2 (CRMP2) 的 SUMO 化增加所致,从而导致 CRMP2/NaV 1.7 相互作用增加和 NaV 1.7 功能活性增加。针对这种前馈调节,我们开发了化合物 194 ,它可抑制由 SUMO 结合酶 Ubc9 介导的 CRMP2 SUMO 化。我们进一步证明 194 可有效降低背根神经节神经元中 NaV 1.7 通道的功能活性并缓解炎症和神经性疼痛。在这里,我们采用了一系列全面的研究方法,包括生化、药理学、遗传学、电生理学和行为分析,以评估 CRMP2 对 Na V 1.7 调节在三叉神经节 (TG) 神经元中的功能影响。我们证实了 Scn9a 、 Dpysl2 和 UBE2I 在 TG 神经元内的表达。此外,我们发现 CRMP2 和 Na V 1.7 之间存在相互作用,其中 CRMP2 在这些感觉神经节中被 SUMO 化。用化合物 194 破坏 CRMP2 的 SUMO 化会解开 CRMP2/Na V 1.7 相互作用,阻碍 Na V 1.7 在质膜上的扩散,随后降低 Na V 1.7 活性。化合物 194 还导致 TG 神经元兴奋性降低。最后,当鼻腔内给药给患有慢性眶下神经压迫性损伤 (CCI-ION) 的大鼠时,194 显著减少了伤害性行为。总之,我们的研究结果强调了 CRMP2 在调节 TG 神经元内的 Na V 1.7 方面的关键作用,强调了这种间接调节在三叉神经性疼痛中的重要性。
Michael Morgan、Juliane W. Schott、Axel Rossi、Christian Landgraf、Athanasia Warnecke、Hinrich Staecker、Anke Lesinski-Schiedat、Brigitte Schlegelberg
摘要:听觉过程涉及一系列事件。外耳捕获声音的能量,并通过外耳道进一步传输到中耳。在中耳,声波被转换成鼓膜和听小骨的运动,从而放大压力,使其足以引起耳蜗液的运动。耳蜗内的行波导致内耳毛细胞去极化,进而释放神经递质谷氨酸。从而,螺旋神经节神经元被激活,通过听觉通路将信号传输到初级听觉皮层。这种复杂的机械感觉和生理机制组合涉及许多不同类型的细胞,其功能受许多蛋白质的影响,包括参与离子通道活动、信号转导和转录的蛋白质。在过去 30 年中,超过 150 个基因的致病变异被发现与听力损失有关。听力损失影响着全球超过 4.6 亿人,目前