XiaoMi-AI文件搜索系统
World File Search System药房反癌课程 - 工作簿
无法区分正常的健康细胞和癌细胞。正常细胞,尤其是那些迅速分裂的细胞会造成一些暂时的损害。这些包括骨髓中的血液形成细胞,性腺中的生殖细胞,胃肠道粘膜和毛囊。某些器官(例如心脏和肺)特别容易或敏感某些细胞毒性药物,并且随着时间的推移,这些器官可能发生毒性。
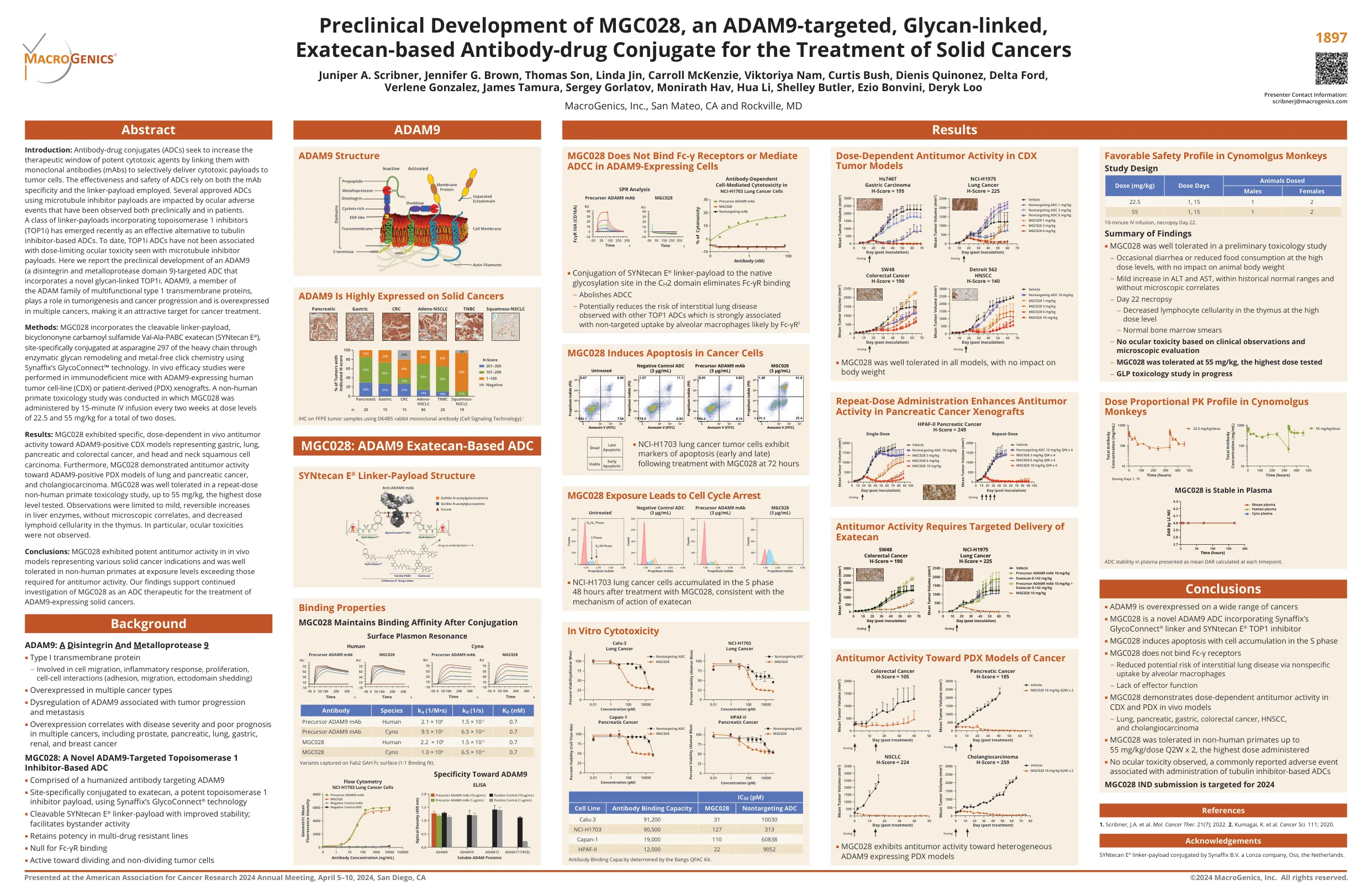
ADAM9 MGC028
简介:抗体-药物偶联物 (ADC) 旨在通过将强效细胞毒性药物与单克隆抗体 (mAb) 连接以选择性地将细胞毒性有效载荷递送至肿瘤细胞来增加强效细胞毒性药物的治疗窗口。ADC 的有效性和安全性取决于 mAb 特异性和所用的连接体-有效载荷。几种使用微管抑制剂有效载荷的已获批 ADC 受到临床前和患者中观察到的眼部不良事件的影响。最近出现了一类结合拓扑异构酶 1 抑制剂 (TOP1i) 的连接体-有效载荷,作为基于微管蛋白抑制剂的 ADC 的有效替代品。迄今为止,TOP1i ADC 尚未与微管抑制剂有效载荷所见的剂量限制性眼部毒性相关。我们在此报告了一种 ADAM9(解整合素和金属蛋白酶结构域 9)靶向 ADC 的临床前开发,该 ADC 结合了一种新型聚糖连接的 TOP1i。 ADAM9 是 ADAM 家族多功能 1 型跨膜蛋白的成员,在肿瘤发生和癌症进展中发挥作用,并在多种癌症中过度表达,使其成为癌症治疗的一个有吸引力的靶点。
利用辐射诱导癌症抗原
摘要:用于治疗癌症的治疗性抗体对晚期患者有效。例如,激活 T 淋巴细胞的抗体可提高许多癌症亚型的存活率。此外,抗体-药物偶联物可有效靶向癌症特异性的细胞毒性药物。本综述讨论了放射诱导抗原,它们是癌症中过度表达的应激调节蛋白。这些可诱导的细胞表面蛋白在细胞对基因毒性应激作出反应时变得易于与抗体结合。主要抗原在所有组织学亚型和几乎所有晚期癌症中均被诱导,但在正常组织中几乎没有表达。通过使用与这些应激调节蛋白特异性结合的治疗性抗体,可利用可诱导抗原。与可诱导抗原 GRP78 和 TIP1 结合的抗体可增强放射治疗在临床前癌症模型中的疗效。细胞毒性药物与抗体的结合进一步改善了癌症反应。本综述重点关注利用放射疗法控制治疗性抗体和抗体-药物偶联物的癌症特异性结合。
肿瘤对放射性药物治疗的反应
对于几乎所有转移性癌症患者来说,治疗都是在预防或减轻癌症进展与控制通常严重的治疗引起的毒性之间取得平衡。实现这种平衡的一种方法是调节治疗的输送。通常,一个细胞毒药物疗程需要多个周期,持续数周至数月。一个治疗周期定义为给药后有一个休息期以从治疗毒性中恢复。如果在初始疗程后病情进展,肿瘤学家会提供后续的细胞毒药物,但这些药物对患者的治疗效益通常会降低,并且毒性很大。因此,我们投入了大量资源来开发新的抗癌药物也就不足为奇了。抗癌药物从首次人体试验到获得食品药品监督管理局批准的失败率为 97% (1)。这些试验主要以靶向药物为主。导致这种高失败率的因素之一是对作用机制的误解;值得注意的是,许多靶向生物制剂的治疗效果是通过脱靶效应实现的( 2 )。努力突破这些药物对患者治疗的极限
如何引用本文Abubakar M,Raza S,Hassan K等。 (2023年3月18日)抗血小板药物在A
摘要:数十年来,广谱细胞毒性药物已在癌症治疗中使用。然而,它们缺乏癌细胞的特异性缺乏,通常会导致严重的副作用,从而限制了效率。因此,已使用抗体试图将细胞毒性药物靶向肿瘤。一种这样的方法是抗体定向的酶前药治疗(Adept),该酶使用肿瘤定向的单克隆抗体,耦合到酶,将仅在肿瘤部位仅在肿瘤部位转化为有毒的一种系统地施用的非毒性前药。是抗体 - 酶复合物的免疫原性,由于大小而慢速间隙加剧,因此限制了重复给药。此外,抗体的单特异性可能会通过反复给药而导致耐药性。我们已经确定了一种新型的短肽序列P700,该序列是源自金属蛋白酶3的人体组织抑制剂-3(TIMP-3),该抑制剂与许多酪氨酸激酶生长因子受体结合并抑制了许多酪氨酸激酶生长因子受体(VEGFRS1-3,FGFRS 1-4和PDGFRS和PDGFRS),这些因素是已知的。在本报告中,我们将P700融合到了他标记的密码子优化,羧肽酶G2(CPG2)中。cpg2是一种用于熟练的细菌酶,它通过去除抑制性谷氨酸残基来激活有效的氮含量促药。重组CPG2-P700在大肠杆菌中高度表达,并通过镍属性色谱法成功纯化。在存在CPG2-P700的情况下,ZD2676P Pro-Pro-Pro-Pro-Pro-Pro-Pro-Pro-Pro-Pro-Pro-Pro-Pro-Pro-Pro-Proug对4T1细胞的细胞毒性显着,而与单独的Prodrug或单独使用CPG2相比。Biolayer干涉法表明,与单独使用CPG2相比,CPG2-P700的vegfr2结合功率增加了100倍,并保留其催化活性,这是通过甲氨蝶呤的裂解确定的。p700是用于酶促毒物治疗的单克隆抗体的潜在有用替代方法,可以同样用于有效递送其他细胞毒性药物向肿瘤组织。
实时活细胞成像助力抗体药物偶联物成功开发
摘要 ADC 是一种新型疗法,可在癌症治疗中提供精准性和有效性。了解作用方式、抗体活性和细胞毒性药物的有效性将有助于生成新的 ADC。活细胞成像提供的多功能性(无论是通过 Incucyte 还是更高分辨率的旋转盘共聚焦显微镜)可用于捕捉成功药物设计的基本特征,并增加获得成功治疗候选药物的可能性。
在线可访问 http://www.tjpr.org http://dx.doi.org/10.4314/tjpr.v24i1.12 原创研究文章 陆地的分离和特性
目的:确定从尼日利亚科吉州阿尼格巴采集的土壤样本中分离的链霉菌属次级代谢物的抗菌、抗溃疡和细胞毒活性。方法:使用盐水虾致死率测定法对不同浓度(62.5、125、250、500、1000 mg/mL)的次级代谢物或参考 K 2 Cr 2 O 7 进行链霉菌次级代谢物的细胞毒活性(浓度范围:62.5 – 1000 mg/mL)。使用白化大鼠溃疡的阿司匹林和乙醇模型评估抗溃疡活性。五组动物,即三组预处理组,其提取物口服浓度为 100 和 200 mg/kg,一组预处理组以奥美拉唑 (30 mg/kg) 作为标准,另一组口服 2 mL/kg 生理盐水 (对照)。使用微量稀释法研究抗菌和抗真菌活性。结果:细胞毒性试验表明,与对照组相比,提取物浓度为 12.5 至 62.5 mg/mL 的毒性较小。对于抗溃疡活性,第 1 组动物表现出白细胞粘膜浸润、上皮细胞大量脱落和细胞出血,而第 2 组有轻度组织糜烂和小溃疡。在 3 至 5 组中,与 100 mg/kg 相比,200 mg/kg 提取物表现出出色的细胞保护作用和熟练的治疗能力,没有明显的副作用,而标准组表现出一些副作用,粘液细胞明显减少(p < 0.05)。次级代谢产物抑制了与溃疡有关的生物(幽门螺杆菌、大肠杆菌、弯曲杆菌属和链球菌属),发挥了治疗作用并保护大鼠免受溃疡。结论:从链霉菌属中分离的次级代谢产物对上皮组织无毒,具有抗菌和抗溃疡活性,因此具有作为抗消化性溃疡药物重要来源的潜力。关键词:抗溃疡、次级代谢产物、细胞毒活性、链霉菌属
声敏靶向脂质体的体外释放动力学建模
癌症是全球主要死亡原因之一,根据世界卫生组织的数据,2020 年报告的死亡病例接近 1000 万 [1]。在各种癌症治疗方式中,化疗通常用作主要治疗或在其他主要治疗(如手术)之后/之前进行,后者被称为辅助疗法和新辅助疗法。根据恶性程度和细胞毒药物的疗效等多种因素,化疗可以发挥不同的作用,如治愈癌症并抑制复发、在无法完全治愈时控制癌症以延长患者生存期、缓解症状以改善患者的生活质量 [2]。化疗通过干扰细胞周期的阶段来抑制癌细胞的生长和增殖。细胞毒化疗针对所有快速生长的细胞,包括正常细胞和恶性细胞,这会导致许多副作用,如脱发、恶心、呕吐和各种器官功能障碍。此外,肿瘤可能在治疗前就对化疗药物产生内在耐药性,也可能在治疗后获得耐药性,从而使药物无效。耐药性被认为是 90% 以上转移性癌症患者治疗失败的主要原因 [3]。临床上避免耐药性的一种方法是使用化疗药物鸡尾酒疗法,例如用于治疗霍奇金淋巴瘤的氮芥、长春新碱、甲基苄肼和泼尼松 (MOPP) 组合 [4];环磷酰胺、
通过在核凝聚物中隔离 β-catenin 来靶向治疗结直肠癌 Kip West 1、Costa Salojin 1、Doug Baumann 1、Adam Talbot 1、Th
研究表明,凝聚物能够调节许多关键的生物过程,而这些凝聚物的异常活性与癌症等疾病的发生有关。这里我们证明缩合物修饰药物(c-mods)针对 CRC 中失调的 β-catenin 转录缩合物活性 • 诱导癌细胞中的 β-catenin 库缩合物,这与体外细胞杀灭相关 • 在包括 CRC 在内的 GI 衍生癌症中表现出强大的细胞毒活性 • 在 CRC 中观察到的体外细胞毒活性在体外转化为 CRC PDO/PDXO 模型 • 体内 c-mod 给药诱导肿瘤细胞中的 β-catenin 库并剂量依赖性下调 β-catenin 驱动的基因转录,这与大量的肿瘤药物水平相关 • 最后,长期服用 c-mods 会在细胞系和 PDX 衍生的 CRC 异种移植模型中产生显着的抗肿瘤活性,并且与 SoC 结合增强了这种活性 综上所述,这些结果表明 β-catenin c-mods 在体外、离体和体内对 CRC 产生强大的抗肿瘤活性,这与 β连环蛋白的定位和转录活性。这些发现凸显了通过冷凝调节靶向异常β-连环蛋白信号在治疗结直肠癌方面的潜力,从而解决这种疾病尚未满足的医疗需求。