XiaoMi-AI文件搜索系统
World File Search System结肠癌疫苗疗法。 -LVHN学术作品
Herbert C. Hoover,Jr,MD*和Jr,Jr,Jr,PhD Herbert C. Hoover,Jr,MD,是宾夕法尼亚州立大学医学院外科手术教授,Anne and Carl Anderson主席;宾夕法尼亚州阿伦敦(Allentown)利哈伊谷医院(Lehigh Valley Hospital)的外科部主席。胡佛博士是堪萨斯人的本地堪萨斯州,1970年在堪萨斯大学医学院获得医学博士学位。 在1970年至1978年之间,他在马萨诸塞州综合医院接受了手术培训,并在1972年至1974年的美国马里兰州贝塞斯达国家癌症研究所的国家癌症研究所的外科手术研究金。Herbert C. Hoover,Jr,MD*和Jr,Jr,Jr,PhD Herbert C. Hoover,Jr,MD,是宾夕法尼亚州立大学医学院外科手术教授,Anne and Carl Anderson主席;宾夕法尼亚州阿伦敦(Allentown)利哈伊谷医院(Lehigh Valley Hospital)的外科部主席。胡佛博士是堪萨斯人的本地堪萨斯州,1970年在堪萨斯大学医学院获得医学博士学位。在1970年至1978年之间,他在马萨诸塞州综合医院接受了手术培训,并在1972年至1974年的美国马里兰州贝塞斯达国家癌症研究所的国家癌症研究所的外科手术研究金。从1978年到1983年,他担任约翰·霍普斯金斯医学院的助理兼副教授和肿瘤学副教授,然后在1983年至1986年担任纽约州立大学斯托尼·布鲁克大学外科肿瘤学系主任。那年,胡佛博士回到马萨诸塞州综合医院担任外科肿瘤研究主管,并担任哈佛医学院外科副教授,直到在1995年担任目前的职位。胡佛博士的研究兴趣主要关注实验和临床免疫疗法,以及人类单克隆抗体的发展。他的临床实践在手术肿瘤学领域很广泛,特别着重于胃肠道肿瘤。
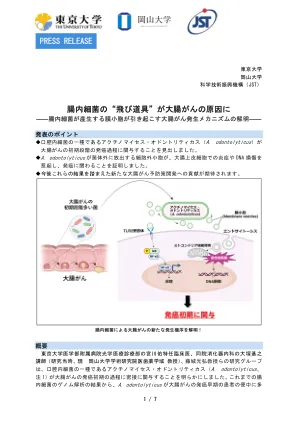
肠道细菌的新闻稿“项目”引起结肠癌
词汇表(注1)放线菌Odontolyticus(A.odontolyticus):一种口腔中的一种居民细菌,据说与牙周疾病有关。据报道,2019年,它存在于结肠癌早期的肠道中。 (注2)细胞外囊泡:细胞释放的脂质覆盖的颗粒,直径约为100 nm。这些囊泡包含多种生理活性物质,被认为在与其他细胞交流中起着作用。细菌产生独特的细胞外囊泡,称为膜囊泡(MVS),它们是相似的结构,但是它们的生产机制和生理活性通常是未知的。 (注3)活性氧:一组高反应性分子作为使用氧气制造能量的副产品。如果产生过量,氧化应激会导致DNA损伤。 (注4)Toll样受体2(TLR2):这是在人类细胞中表达的Toll样受体之一,并充当病原体(例如微生物)的传感器,到目前为止已经确定了10种类型的受体。 TLR2主要识别细菌细胞壁的成分,并将其传输到产生免疫反应的下游信号。 (注5)核细菌核(F.nucleatum):一种口腔中的一种居民细菌,是引起牙周疾病的细菌之一。近年来,有许多与结肠癌关联的报道。 (注6)永生的人类结肠上皮细胞:出于研究目的,通过导致正常的,非癌症的人类结肠上皮细胞永生的细胞失去了限制细胞分裂的能力。 (注7)NF-κB信号:调节炎症反应的重要信号之一,调节响应特定刺激的炎症细胞因子的表达。它参与慢性炎症,并参与肿瘤形成和进展。 (注8)敲除:一种抑制特定基因表达的技术。 (注9)从人IPS细胞中得出的迷你肠:由人IPS细胞创建的2017年肠道的3D器官模型。这项研究中使用的肠道的特征是肠上皮的外部取向。 (注10)发育不良:形态与正常形态不同的疾病,这被认为是癌前病变的早期阶段。
阿司匹林在结肠癌治疗中的再利用:治疗方法
药物再利用,即探索现有药物的新用途,与开发新药物相比具有显著优势。再利用的药物已经经过安全测试,降低了失败的可能性。预先存在的数据和制造知识缩短了流程。开发成本更低,估计为 3 亿美元,而新药的成本为 20 至 30 亿美元。再利用的药物可以在 3 至 12 年内进入市场,而新药则需要 10 至 17 年。总体而言,药物再利用是一种有前途的方法,可以更快、更便宜地开发新疗法。结肠癌治疗面临障碍。传统药物开发速度慢且成本高。本综述强调药物再利用是一种战略解决方案。通过寻找现有药物的新用途,我们可以克服这些挑战。本综述探讨了结肠癌药物再利用的各种方法:网络模型:识别药物与疾病之间的联系。计算机辅助方法:利用软件预测药物-靶标相互作用。机器学习算法:分析大量数据集以发现隐藏的模式。分子对接技术:模拟药物如何与靶分子结合。本综述强调阿司匹林是结肠癌再利用的有希望的候选药物。其潜在益处是阿司匹林可能减缓癌细胞分裂。同时还强调了人工智能和网络建模在药物再利用中的作用。药物再利用为克服结肠癌治疗的挑战提供了一种有希望的策略。通过利用尖端的计算方法和个性化医疗,我们可以为患者开发更有效、更高效的治疗方案。
第 34 章 APC 的故事:源自息肉的结肠癌
第 34 章 APC 的故事 – 源自息肉的结肠癌 230127be 抗癌药物:发现和寻求治愈方法的故事 Kurt W. Kohn,医学博士,哲学博士 美国国立癌症研究所发展治疗分部名誉科学家 马里兰州贝塞斯达 kohnk@nih.gov 第 34 章 APC 的故事:源自息肉的结肠癌。 上一章讨论了一种由单个基因 RB 突变引起的癌症——视网膜母细胞瘤。这是一个独特的案例,因为绝大多数癌症都是在不同基因发生一系列突变后才发生的。一个典型的例子是结直肠癌,尤其是源自身体左侧降结肠和直肠息肉的常见癌症。这些恶性肿瘤发展相对较慢,通常需要约 10 年的时间,在此期间它们会经历一系列突变或其他基因变化,从而有时间在恶性癌症出现之前通过结肠镜检查切除息肉(图 34.1)。升结肠中也会发生类似的突变过程,特别是第 25 章中讨论的 DNA 错配修复基因突变。但在这里,我们关注的是降结肠和直肠息肉中发展的癌症。导致结直肠息肉癌症的多步骤突变过程。结直肠癌是全球发病率或死亡率第三高的癌症,其中最常见的是降结肠癌或直肠癌。这些癌症的主要特征是染色体不稳定性,当有丝分裂不能均等地划分染色体或染色体重复或删除时就会出现这种情况。这与升结肠癌形成鲜明对比,升结肠癌的特点是微卫星不稳定性(第 25 章)。染色体不稳定的一个标志是 APC(腺瘤性结肠息肉)基因的功能丧失,导致 Wnt 通路失活(后面部分讨论),这是结肠息肉癌变的第一步(图 34.2)。在 APC 之后,在癌变过程中序列中其他经常受损的基因是 KRAS(第 18 章)、SMAD2 和 4。
乳腺癌、结肠癌和胰腺癌细胞的有效药物组合
抗癌药物组合可克服耐药性并提供新的治疗方法 1,2。可能的药物组合数量远远超过临床上可以测试的数量。系统地确定活性组合及其最有效的组织和分子环境的努力可以加速联合治疗的开发。在这里,我们评估了 2,025 种临床相关的双药组合的效力和功效,生成了一个包含 125 种分子特征的乳腺癌、结直肠癌和胰腺癌细胞系的数据集。我们表明药物之间的协同作用很少见且高度依赖于环境,而靶向药物的组合最有可能产生协同作用。我们结合多组学分子特征来识别组合生物标志物并指定协同药物组合及其活性环境,包括基底样乳腺癌和微卫星稳定或 KRAS 突变型结肠癌。我们的结果表明,伊立替康和 CHEK1 抑制在微卫星稳定或 KRAS – TP53 双突变结肠癌细胞中具有协同作用,导致细胞凋亡并抑制肿瘤异种移植生长。本研究确定了不同分子亚群中临床相关的有效药物组合,并可作为指导合理开发组合药物治疗的资源。
基于多质质的疫苗用于结肠癌治疗和预防
结果:与志愿者相比,结直肠癌患者血清中CDC25B,COX2,RCAS1和FASTIN1的血清IgG显着升高(CDC25B P = 0.002,Cox-2,Cox-2 P = 0.001,fascin1,fascin1和Rcas1 P <0.0001)。针对每种蛋白质鉴定了与人II类MHC结合的表位,并针对肽的T细胞和T细胞鉴定了肽和相应的重组蛋白的特异性,并从人类淋巴细胞中产生,以验证这些蛋白质为人类抗原。某些肽在小鼠和人类之间是高度同源的,在免疫后,小鼠既开发了肽和蛋白质的特异性IFN-分泌细胞对Cdc25b,Cox2和RCAS1的反应,却不是fascin1。与对照相比,用CDC25B或COX2肽免疫的FVB/NJ小鼠对合成元MC38肿瘤的生长显着抑制(p <0.0001)。RCAS1肽疫苗接种没有抗肿瘤作用。 在用AOM治疗的Cdc25b或Cox2肽小鼠免疫后,与对照组相比,用AOM处理的显着较少的肿瘤(P <0.0002),其中50%的小鼠在每个抗原组中保持无肿瘤。 与对照组相比,用Cdc25b或Cox2肽免疫的APC最小小鼠的肠肿瘤较少(分别为p = 0.01和p = 0.02)。RCAS1肽疫苗接种没有抗肿瘤作用。在用AOM治疗的Cdc25b或Cox2肽小鼠免疫后,与对照组相比,用AOM处理的显着较少的肿瘤(P <0.0002),其中50%的小鼠在每个抗原组中保持无肿瘤。与对照组相比,用Cdc25b或Cox2肽免疫的APC最小小鼠的肠肿瘤较少(分别为p = 0.01和p = 0.02)。
细胞疗法作为针对结肠癌干细胞的靶向疗法
摘要:癌症干细胞 (CSC) 是肿瘤内的一小群细胞,具有自我更新、分化和致瘤性等特性。CSC 被认为是一种合理的治疗靶点,因为它们是肿瘤复发、转移和常规疗法耐药的原因。选择性靶向 CSC 是一种有前途的策略,可以消除肿瘤细胞的繁殖并损害整体肿瘤的发展。最近的研究表明,几种免疫细胞通过调节不同的 CSC 维持或增殖途径在调节肿瘤细胞增殖中起着至关重要的作用。使用 T 细胞、自然杀伤 (NK) 细胞、巨噬细胞或干细胞选择性靶向结直肠癌 (CRC) 中的肿瘤细胞或 CSC 的细胞免疫疗法取得了巨大进展。本综述总结了可能从所述疗法中受益的 CRC 分子谱以及针对 CSC 的细胞疗法中使用的主要载体。我们还讨论了在 CRC 晚期阶段结合常规和/或当前靶向治疗的挑战、局限性和优势。
线粒体融合蛋白 2 表达对结肠癌预后的影响
线粒体功能障碍和糖酵解激活被广泛认为是癌症的标志 (5)。线粒体融合蛋白 2 (MFN2) 编码位于线粒体外膜上的 GTPase 蛋白,也称为增生抑制基因。它最初是在自发性高血压大鼠的血管平滑肌细胞中发现的 (6)。先前的研究表明,MFN2 疾病与高血压、腓骨肌萎缩症、肥胖症、糖尿病、动脉粥样硬化和癌症等多种疾病有关 (7,8)。MFN2 在许多癌症中起着肿瘤抑制因子的作用,包括宫颈癌、肝细胞癌、胰腺癌、乳腺癌、胃癌和膀胱癌 (9-11)。然而,据我们所知,MFN2 与结肠癌之间的潜在关系尚未得到充分研究。
共识分子亚型CMS4结肠癌的临床挑战
在Guinney及其同事在2015年的具有里程碑意义的研究中的共识分子亚型(CMS)的定义,基于大量转录组的专业填充,已将结直肠癌的新时代视为具有不同的实体,并具有不同的实验,并具有特定的基因疗法,基因分子疗法,临床上,分子,分类(Morecular),分类(Molecormult)。从那时起,CMS分类已成为描述大肠癌多样性的重要参考。这显着来自更专门的深入研究,表明该分类也与肿瘤微环境有关(TME;参考2),miRNA(3)或表观基因组景观(4)。表1总结了每个子类型的各种特征,我们将读者引用了几个出色的评论,以获取更多细节(5,6)。Brie pl Y,CMS1组(占患者的14%),称为“免疫”,在微卫星不稳定性的患者中富含(MSI;参考1)。“典型” CMS2(患者的37%)和“代谢” CMS3(13%的患者)亚组的特征都是上皮类型和良好的
苍术苷靶向癌症相关成纤维细胞并抑制结肠癌转移
肿瘤微环境(TME)是一个复杂的组织环境,包括癌细胞、癌相关成纤维细胞(CAFs)、炎症细胞、巨噬细胞、髓系抑制细胞、肥大细胞和细胞外基质(ECM)(1)。CAFs是TME的主要成分,在肿瘤的发生、发展和转移中起着至关重要的作用。此外,CAFs是肿瘤中活化的成纤维细胞,主要来源于成纤维细胞,但也可能来源于血管平滑肌细胞、周细胞和骨髓间充质细胞,或来源于上皮或内皮-间质转化。成纤维细胞活化蛋白(FAP)和α-平滑肌肌动蛋白(α-SMA)通常被认为是CAFs的分子标记(2,3)。然而,COX-2/PGE2 信号、TGF-β 和外泌体是三种主要的串扰,它们促进了 CAFs 与 TME 细胞之间的广泛相互作用。此外,CAFs 与所有肿瘤前细胞都有正或负的相互作用,包括癌细胞、调节性 T 细胞、内皮细胞、M2 巨噬细胞、癌症干细胞、髓系抑制细胞、肿瘤相关树突状细胞、细胞毒性 T 淋巴细胞、自然杀伤 (NK) 细胞等。这些串扰通常是肿瘤进展的原因 (4-6)。此外,CAFs 在不同水平上调节抗肿瘤免疫反应,可能影响先天性和适应性抗肿瘤免疫反应。因此,CAFs 在肿瘤进展中起着关键作用 (7)。