XiaoMi-AI文件搜索系统
World File Search SystemCK-4021586的临床前表征,一种新的心脏肌球蛋白抑制剂,用于治疗肥厚性心肌病
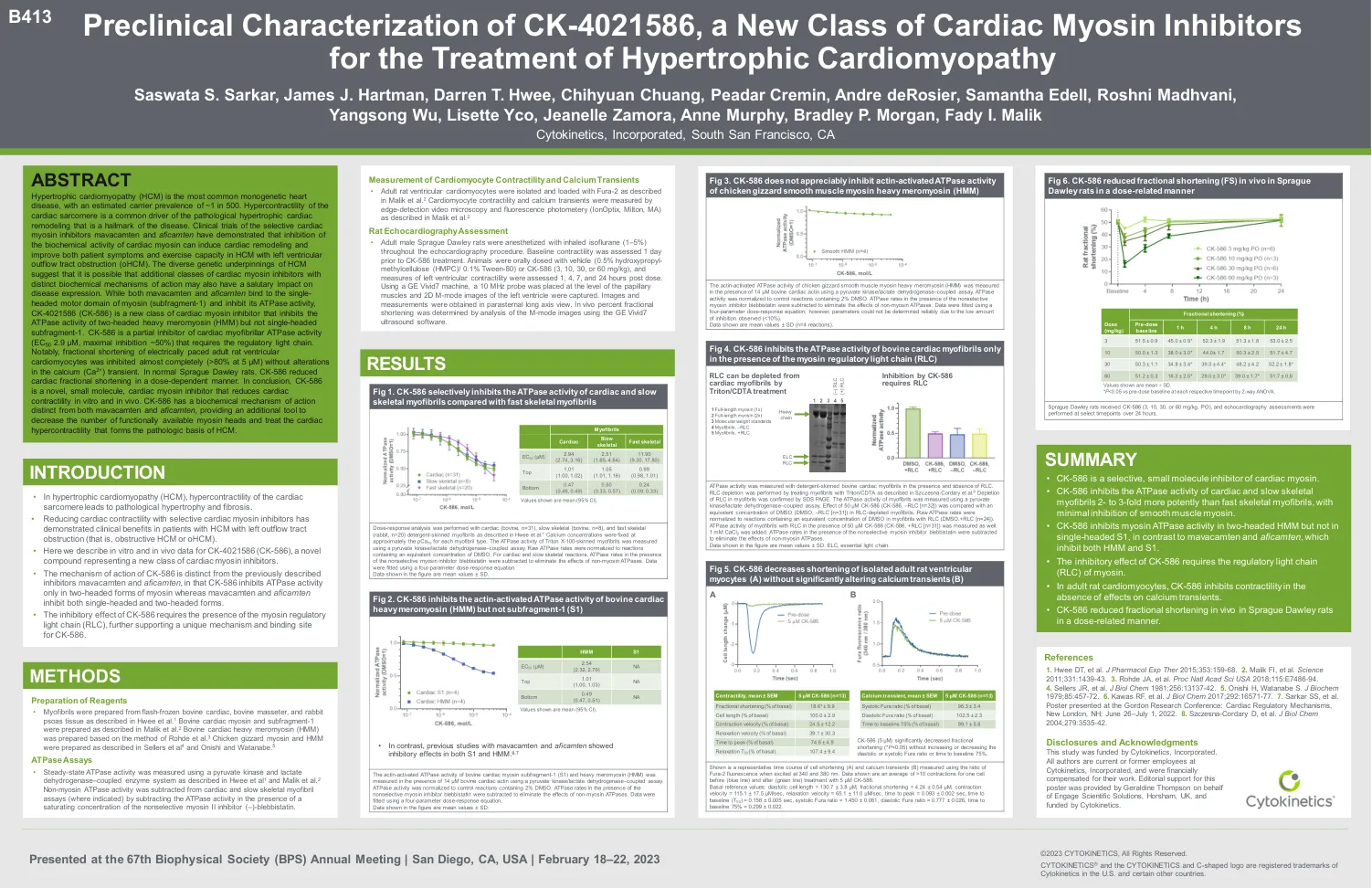
•在肥厚性心肌病(HCM)中,心脏肉瘤的超收缩性导致病理肥大和纤维化。•使用选择性心脏肌球蛋白抑制剂来降低心脏收缩性,显示出患有左流道阻塞的HCM患者的临床益处(即阻塞性HCM或OHCM)。•在这里,我们描述了CK-4021586(CK-586)的体外和体内数据,这是一种新型化合物,代表了一种新的心脏肌球蛋白抑制剂。•CK-586的作用机理与先前描述的抑制剂Mavacamten和Aficamten不同,因为CK-586仅以两种肌球蛋白的形式抑制ATPase活性,而Mavacamten和Aficamten和Aficamten均抑制了单头和两头的形式。•CK-586的抑制作用需要肌球蛋白调节轻链(RLC),进一步支持CK-586的独特机制和结合位点。
肌球蛋白力引发 F- 肌动蛋白结构景观,介导机械敏感蛋白识别
。CC-BY 4.0 国际许可证下可用(未经同行评审认证)是作者/资助者,他已授予 bioRxiv 永久展示预印本的许可。它是此预印本的版权持有者此版本于 2024 年 8 月 17 日发布。;https://doi.org/10.1101/2024.08.15.608188 doi:bioRxiv 预印本
小细胞肺癌 (NSCLC)
自 2023 年 11 月 1 日起,MBS 上将列出三个新的病理项目,用于检测非小细胞肺癌(非鳞状)患者的表皮生长因子受体 (EGFR)、原癌基因 B-Raf (BRAF)、KRAS 原癌基因 (KRAS) 和 MET 原癌基因、MET 受体酪氨酸激酶外显子 14 (MET 外显子 14) 的变异以及至少一种间变性淋巴瘤激酶 (ALK)、ROS 原癌基因 1 (ROS1)、RET 原癌基因 (RET)、神经营养性原肌球蛋白受体激酶 1 (NTRK1)、神经营养性原肌球蛋白受体激酶 2 (NTRK2) 和神经营养性原肌球蛋白受体激酶 3 (NTRK3) 的融合状态组织学或未另行指定的组织学),使用小型基因组。本情况说明书的附件 A 列出了新增和修订的项目。
对心脏肌球蛋白力学和动力学的变构调节,由缀合的omega -7,9 trans -Fat瘤胃酸
关键点r直接与心脏肌球蛋白-2运动结构域的直接结合增加了正磷酸盐的释放速率,并增加了低负载下心肌的Ca 2 +反应性。瘤胃酸的生理细胞浓度会影响β-心脏肌球蛋白的超浮标和无序的松弛状态的ATP周转率,从而导致肌肌酸代谢负荷净增加。r在Ca 2 +激活的小梁中,瘤胃酸对产生力的机制产生直接抑制作用,而不会影响生成力的电动机的数量。r在饱和肌动蛋白浓度的存在下,瘤胃酸与200 nm的EC 50与β-心肌球蛋白-2运动结构域结合。分子对接研究提供了有关结合位点,结合模式以及相关的变构通信途径的信息。r游离叛变酸可能超过心肌细胞中的阈值,而收缩效率降低并干扰针对心脏肌球蛋白的小分子疗法。
项目标题:生物学样本中新的第二次谐波生成方式,以分离胶原蛋白和肌球蛋白
肌球蛋白移动真核生物的肌肉,是一种微小的分子运动[1]。它通过消耗三磷酸腺苷(ATP)来产生力并进行机械工作。作为线性电动机,它可以通过活细胞内的细胞骨架的轨道样肌动蛋白丝或微管进行运动。以这种方式,亚细胞结构,以及较大的单位(例如细胞或生物)可以以定向方式移动[1,2]。使用基因工程方法,已经有可能产生向后移动的肌球蛋白纳米运动[3]。X射线结构分析和动力学研究等方法进一步阐明了具有技术兴趣的运动蛋白的有序纳米结构的自我组织。对于分子医学,了解分子线性运动和组织中稳定结构之间的结构关系也很重要。骨骼肌由伸长的纤维细胞和肌纤维沿整个长度平行排列[1]组成。肌原纤维包含纵向肉瘤,其肌动蛋白肌膜的高阶和肌球蛋白蛋白具有收缩。骨骼肌的众所周知的横向条纹是由于肌纤维在肌肉纤维中的平行排列而产生的(图1)。几种肌肉纤维沿相同方向捆绑在一起。这些由细胞外基质的结构蛋白(尤其是胶原蛋白纤维)组织。从胶原蛋白家族的大而异构的群体中,发现大部分是纤维状胶原蛋白。但是这种变化可能具有很大的潜力。由于非中心对称结构,胶原蛋白和肌球蛋白的特异性显微成像是可能的[4,5,6,7,8]。使用聚焦激光辐射的超短脉冲会导致瞬态高功率密度和二阶频率加倍(第二次谐波产生,SHG)[7,8]。通过在近红外范围内使用激发波长,第二个谐波渗透到组织中,肌肉组织可以在三个维度中无损地映射(图2)。SHG极化法可用于区分肌球蛋白和胶原蛋白,并进一步胶原蛋白纤维的方向[7,8,9]。可以通过对向后信号进行评估来获得进一步的对比信息。到目前为止,几乎没有任何方法可以调节SHG生成波长以区分肌球蛋白和胶原蛋白纤维[8,9]。但是,一些矛盾的结果要求通过评估光谱信息进行多模式研究。到目前为止,在生物样品中的第二次谐波中,尚未证明完全kleinman对称性的假设和SHG效率的单调降低。相反,最近的研究表明了一种复杂的行为,更明显地使用向后信号而不是前向信号[8,9]。
EDG-7500,一种可保留固有性肌球蛋白运动功能的心脏肌肉瘤调节器,改善了HC
本演讲包含涉及Edgewise Therapeutics,Inc。的实质性风险和不确定性的前瞻性陈述(“ Edgewise”或“ Company”)。本演讲中包含的历史事实陈述以外的所有陈述,包括有关我们未来的财务状况,运营成果,业务战略和计划的陈述,以及对未来运营的管理目标以及有关行业趋势的陈述,都是前瞻性陈述。这种前瞻性陈述包括有关Edgewise的药物发现平台的潜力和期望的陈述; Edgewise的候选产品和计划,包括EDG-7500; EDG-7500的此类里程碑的预期里程碑和时间安排,包括EDG-7500和临床试验数据报告的预期时间;关于Edgewise产品候选产品的市场机会的陈述;有关Edgewise产品候选和计划的管道的陈述;以及有关Edgewise财务状况(包括其流动性)的声明。在某些情况下,您可以按术语识别前瞻性陈述,例如“估算”,“打算”,“五月”,“计划”,“潜在”“威尔”或这些术语或其他类似表达式的否定。
crispr/cas9介导了太平洋牡蛎中肌球蛋白必需轻链基因的高效敲除(
抽象的太平洋牡蛎(Crassostrea gigas)是世界上种植最广泛的贝类物种之一。由于其经济价值和复杂的生命周期,涉及从自由宽松的幼虫到无柄少年的急剧变化,因此C.Gigas被用作发展,环境和水产养殖研究的模型。但是,由于缺乏功能分析的遗传工具,与生物或经济特征相关的基因功能无法轻易确定。在这里,我们报告了CRISPR/CAS9技术在C.Gigas中成功应用肌球蛋白基本光链基因(CGMELC)。C.注入SGRNA/CAS9的GIGAS胚胎在目标部位包含广泛的indel突变。突变幼虫显示出缺陷的肌肉和运动降低。此外,CGMELC的敲除破坏了幼虫中肌球蛋白重链阳性肌纤维的表达和图案。一起,这些数据表明CGMELC参与牡蛎幼虫中的幼虫肌肉收缩和肌发生。
平均主动力,波动和自我载荷
例如,MPS的动力蛋白和动力蛋白沿微管移动,而肌球蛋白家族可以沿丝状肌动蛋白移动。他们的运动依赖载荷依赖于9,10,并且可以达到的最大速度受到可用的ATP浓度。11 ATP水解对化学势的局部耗散驱动MPS脱离平衡。他们的运动方向取决于可以行走的局部前后不对称性不对称性。在最小的尺度上生成非平衡驱动,MP构成了一类活动物质12-14,其中时间反转对称性和平衡波动 - 降解关系被打破。在活细胞中,MP共同运输包括细胞器在内的各种货物。15–19从几个到数百名国会议员可以参与这种运输。20–25多个MP驱动的货物动力学的理论研究使用相等的载荷共享近似值或有限数量的MPS的详细数值模拟。26–33 MPS之间的耦合可能来自直接的机械连接,如肌球蛋白丝中,34分子拥挤26–33 MPS之间的耦合可能来自直接的机械连接,如肌球蛋白丝中,34分子拥挤
ihceasy myl7 myl7现成的IHC套件
背景myl7,也称为肌球蛋白轻链2a(MLC2A),对于心脏发育至关重要。MYL7在心脏中的表达主要仅限于中庭。因此,其表达被认为是心房心肌细胞的有用标记。
给编辑的信
2+ - handling。据报道,肉瘤蛋白滴定在调节对心脏僵硬的收缩反应以及一个重要的治疗靶标中起着至关重要的作用,尤其是在保留射血分数(HFPEF)的HF中(2)。在生理环境下,α-肌球蛋白重链(α-MHC)尾巴与钛合金相关以制成厚的肌膜。厚肌膜的稳定结构对于维持心脏的正常结构和收缩功能至关重要。然而,决定肌球蛋白和钛合金之间结合的关键因素尚不清楚。在2019年,Zhao教授首先证明了乳酸介导的一种转化后修饰的一种乳酸化,在癌症代谢和免疫细胞中起着重要作用(3)。乳酸化也与血管功能,神经调节,缺氧,糖酵解和细胞代谢有很强的相关性。虽然乳酸曾经被认为是新陈代谢的副产品,但现在它作为能源的作用至关重要