XiaoMi-AI文件搜索系统
World File Search System使用胞嘧啶碱基编辑器
S. Haihua Chu,Daisy Lam,Michael S Packer,Jenny Olins,Alexander Liquori,Kyle Rehberger,Conrad Rinaldi,Jeffrey Marshall,Calvin Lee,Bo Yan,Bo Yan,Jeremy Decker,Jeremy Decker,Bob Gantzer,Scott Haskett,Scott Haskett,Tanggis Bohnuud,David Born,David born born barr barr,luiis,luuis,luuis。 Slaymaker,Nicole Gaudelli,Sarah Smith,Adam Hartigan和Giuseppe CiaramellaS. Haihua Chu,Daisy Lam,Michael S Packer,Jenny Olins,Alexander Liquori,Kyle Rehberger,Conrad Rinaldi,Jeffrey Marshall,Calvin Lee,Bo Yan,Bo Yan,Jeremy Decker,Jeremy Decker,Bob Gantzer,Scott Haskett,Scott Haskett,Tanggis Bohnuud,David Born,David born born barr barr,luiis,luuis,luuis。 Slaymaker,Nicole Gaudelli,Sarah Smith,Adam Hartigan和Giuseppe Ciaramella
Bisulfite胞嘧啶转化为尿嘧啶结果,...
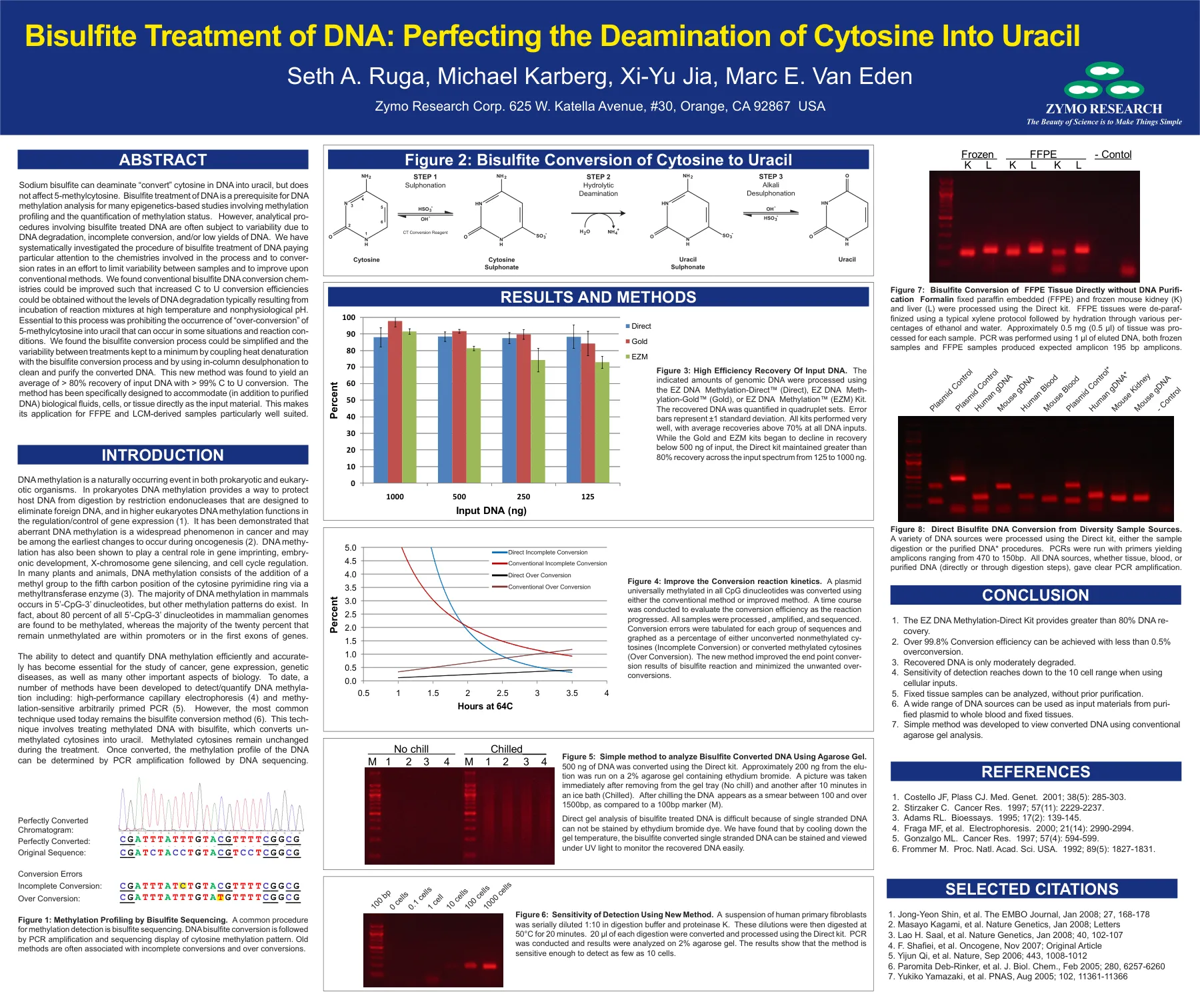
硫酸钠可以在DNA中脱氨酸“转化”胞嘧啶,但不会影响5-甲基胞霉素。Bisulfite对DNA的治疗是许多基于表观遗传学的研究的DNA甲基化分析的先决条件,这些研究涉及甲基化分析和甲基化状态的定量。然而,涉及甲硫酸硫酸含DNA的分析率通常由于DNA降解,不完整的转化率和/或低单位的DNA产量而导致可变性。我们已经系统地研究了硫酸氢盐治疗DNA的程序,特别注意该过程中涉及的化学物质并转化sion速率,以限制样品之间的变异性并改善常规方法。我们发现,可以改善常规的硫酸含量DNA转化化学化学液体,以使C到U转化效率的提高,而无需在高温和非生理学pH值下孵育反应混合物的DNA降解水平。对这一过程必不可少的是禁止在某些情况下发生的5-甲基胞嘧啶“过度转化”到尿嘧啶中。我们发现,可以简化硫酸盐转化过程,并通过将热变性与甲硫酸盐转化率耦合和使用柱内的脱硫偶联来清洁和纯化转换后的DNA,并通过将热量变性耦合到最低限度。这种新方法的平均得出的输入DNA平均恢复了> 99%C到U转换。这使其适用于FFPE和LCM衍生的样品,特别适合。该方法已被专门设计用于将(除了纯化的DNA)直接作为输入材料(除纯化的DNA)生物流体,细胞或组织。
胞嘧啶修饰的模块化氧化及其在5-羟基甲基胞嘧啶的直接和定量测序中的应用
摘要:胞嘧啶修饰的选择性,有效和可控的氧化对于表观遗传分析很有价值,但仅进行了有限的进展。在这里,我们介绍了两个模块化化学氧化反应:使用4-乙酰胺-2,6,6,6-6,6-四甲基二甲基二甲基二甲基二氨基氨基氨基氨基氨基氨基氨基氨基氨基氨基氨基氨基氨基甲氨基甲甲基胞嘧啶(5HMC)转化为5-甲酰基胞嘧啶(5FC)(5FC) 5-羧基氨酸(5CAC)通过固定氧化。这两种反应在双链DNA上都是轻度且有效的。我们将这两种氧化与硼烷还原集成在一起,以开发化学辅助的吡啶硼烷测序加(CAPS+),以直接和定量映射的5hmc。与CAPS相比,CAP+提高了转化率和假阳性速率。我们将CAPS+应用于小鼠胚胎干细胞,人正常脑和胶质母细胞瘤DNA样品,并在分析羟甲基甲基甲基时表现出了较高的敏感性。
利用 TadA 的下一代胞嘧啶碱基编辑器
• 脱氨酶的定向进化 • PAM 变体碱基编辑器 • 定向进化 Cas9 以创建用于 BE 的非 NGG PAM 变体 • 密码子、NLS 和接头优化 • 环状置换体和镶嵌碱基编辑器 • DNA 脱靶评估 • RNA 脱靶评估 • 旁观者编辑最小化 • 引导 RNA 工程 • 离体和体内 BE 递送 • 最小化脱靶活性的工程 BE • HSC、肝细胞和 T 细胞的离体碱基编辑 • ABE 的低温电子显微镜结构 • 小鼠体内碱基编辑 • 非人类灵长类动物体内编辑
由 TadA 变体生成的改进的胞嘧啶碱基编辑器
胞嘧啶碱基编辑器 (CBE) 可实现可编程的基因组 C·G 到 T·A 转换突变,通常包含经过修饰的 CRISPR-Cas 酶、天然存在的胞嘧啶脱氨酶和尿嘧啶修复抑制剂。先前的研究表明,利用天然存在的胞嘧啶脱氨酶的 CBE 可能导致无引导的全基因组胞嘧啶脱氨。尽管随后报道了可减少随机全基因组脱靶的改进型 CBE,但这些编辑器的靶向性能可能不理想。本文,我们报告了使用 TadA 的工程变体 (CBE-T) 的 CBE 的生成和表征,这些变体可在序列多样的基因组位点上实现高靶向 C·G 到 T·A,在原代细胞中表现出强大的活性,并且不会导致全基因组突变的可检测升高。此外,我们报道了胞嘧啶和腺嘌呤碱基编辑器 (CABE),它们可催化 A 到 I 和 C 到 U 编辑 (CABE-T)。与 ABE 一起,CBE-T 和 CABE-T 可使用实验室进化的 TadA 变体对所有转换突变进行可编程安装,与之前报道的 CBE 相比,这些变体具有更好的特性。
使用胞嘧啶碱基编辑器 cccDNA失活
1。Beam Therapeutics,美国马萨诸塞州剑桥2。 里昂癌症研究中心,Inserm,U1052,法国里昂3。 Hospices Civils de Lyon(HCL),法国里昂。 4。 里昂大学,UMR_S1052,UCBL,69008里昂,法国。 5。 法国大学(IUF)Institut Universitaire Universitaire Universitaire,法国75005。Beam Therapeutics,美国马萨诸塞州剑桥2。里昂癌症研究中心,Inserm,U1052,法国里昂3。Hospices Civils de Lyon(HCL),法国里昂。4。里昂大学,UMR_S1052,UCBL,69008里昂,法国。5。法国大学(IUF)Institut Universitaire Universitaire Universitaire,法国75005。
DNA胞嘧啶甲基化动力学和园艺作物中的功能作用
胞嘧啶的甲基化是一种保守的表观遗传修饰,在调节甲基转移酶和去甲基酶的调节下,植物中甲基化的动态平衡。 近年来,DNA甲基化在调节动植物的生长和发展中的研究已成为研究的关键领域。 本综述描述了植物中DNA胞嘧啶甲基化的调节机制。 它总结了关于果实成熟,发育,衰老,植物高度,器官大小以及在园艺作物中生物和非生物胁迫下的果实成熟,发育,衰老,植物高度,器官大小的表观遗传修饰的研究。 审查为理解DNA甲基化机制及其与繁殖,遗传改善,研究,创新和剥削园艺作物的新品种的相关性提供了理论基础。胞嘧啶的甲基化是一种保守的表观遗传修饰,在调节甲基转移酶和去甲基酶的调节下,植物中甲基化的动态平衡。近年来,DNA甲基化在调节动植物的生长和发展中的研究已成为研究的关键领域。本综述描述了植物中DNA胞嘧啶甲基化的调节机制。它总结了关于果实成熟,发育,衰老,植物高度,器官大小以及在园艺作物中生物和非生物胁迫下的果实成熟,发育,衰老,植物高度,器官大小的表观遗传修饰的研究。审查为理解DNA甲基化机制及其与繁殖,遗传改善,研究,创新和剥削园艺作物的新品种的相关性提供了理论基础。
FFPE DNA 显示出两种主要错误特征,它们源自胞嘧啶和甲基胞嘧啶的脱氨作用,可以使用不同的修复策略来缓解
摘要避免由损伤引起的测序错误是准确识别 DNA 样本中中到稀有频率突变的关键步骤。在 FFPE 样本中,胞嘧啶部分的脱氨作用代表了导致 DNA 材料丢失和测序错误的重大损伤。在这项研究中,我们证明,虽然胞嘧啶和甲基化胞嘧啶部分的脱氨作用造成的损伤会导致 C 到 T 的转换升高,但错误概况和调解策略是不同的并且容易区分。虽然胞嘧啶脱氨引起的损伤诱导测序错误是由 NGS 工作流程中常用的末端修复步骤驱动的,但甲基化胞嘧啶脱氨引起的 DNA 损伤是 CpG 位点测序错误的另一个主要因素。尿嘧啶 DNA 糖基化酶和人胸腺嘧啶 DNA 糖基化酶可以分别消除和减轻 FFPE DNA 样本中的两种损伤,从而显著提高中等等位基因频率变异鉴定的测序准确性。
合理设计 APOBEC3B 胞嘧啶碱基编辑器,提高特异性
金帅, 1, 2, 6 费红远, 1, 2, 6 朱子旭, 1, 2, 6 罗英锋, 3, 6 刘金星, 1 高胜汉, 3 张锋, 4 陈宇航, 5 王彦鹏, 1, 2,* 和高彩霞 1, 2, 7,* 1 中国科学院遗传与发育生物学研究所、种子设计创新研究院、植物细胞与染色体工程国家重点实验室、基因组编辑中心,北京,中国 2 中国科学院大学现代农业学院,北京,中国 3 中国科学院微生物研究所、微生物资源国家重点实验室,北京,中国 4 明尼苏达大学植物与微生物生物学系、植物精准基因组学中心、微生物与植物基因组学研究所,明尼苏达州明尼阿波利斯55108,美国 5 中国科学院遗传与发育生物学研究所,种子设计创新研究院,分子发育生物学国家重点实验室,北京,中国 6 这些作者贡献相同 7 主要联系人 *通讯地址:yanpengwang@genetics.ac.cn (YW),cxgao@genetics.ac.cn (CG) https://doi.org/10.1016/j.molcel.2020.07.005
改进的胞嘧啶碱基编辑器的基因组和转录组范围的脱靶分析
1 博伊斯汤普森研究所,纽约州伊萨卡 14853,美国;2 马里兰大学植物科学与景观建筑系,马里兰州帕克分校,美国;3 扬州大学农学院,江苏省作物基因组学与分子育种重点实验室/植物功能基因组学教育部重点实验室,扬州 225009,中国;4 扬州大学江苏省粮食作物现代生产技术协同创新中心,扬州 225009,中国;5 康奈尔大学植物育种与遗传系,纽约州伊萨卡 14853;6 马里兰大学生物科学与生物技术研究所,马里兰州罗克维尔 20850。Ɨ 上述作者对本文贡献相同。