XiaoMi-AI文件搜索系统
World File Search System治疗局部猫单侧溃疡性角膜炎
摘要 角膜炎是一种眼部疾病,由炎症细胞浸润角膜引起,角膜混浊,导致动物视力受损。角膜炎可能是由于外角膜和结膜不断暴露于有害物质(例如风、灰尘和微生物(细菌、真菌和病毒))以及动物自身毛发等其他刺激源所致。撰写本报告旨在确定自体血清给药对角膜炎的有效性。病例动物是一只当地雌猫,4 个月大,体重 0.9 公斤,右眼流泪发红。体格检查显示眼角膜混浊,流泪过多。检眼镜检查显示眼内出血,荧光素眼科试纸测试显示角膜溃疡呈阳性。病例动物被诊断为溃疡性角膜炎。治疗方式为口服抗生素强力霉素、妥布霉素滴剂及自体血清。病例动物的眼部状况在治疗后第二周有所改善,但猫的右眼仍然有些混浊。病例动物应继续治疗以达到最大治疗效果,并佩戴项圈以加快愈合过程。
通过CRISPR-CAS9-介导的Hibit标记
许多蛋白质家族由多种高度同源蛋白组成,无论它们是由不同基因编码还是来自相同基因组位置的编码。某些同工型的优势与各种病理状况(例如癌症)有关。研究中蛋白质同工型的检测和相对定量通常是通过免疫印迹,免疫组织化学或免疫荧光来完成的,其中使用针对特定家族成员的同工型特异性表位的抗体。但是,同工型特异性抗体并非总是可用的,因此无法破译同工型特异性蛋白表达模式。在这里,我们描述了多功能11氨基酸标签的插入到感兴趣蛋白质的基因组位置中。此标签是开发的,由Promega(美国威斯康星州Fitchburg)发行。本协议描述了高度同源蛋白的精确蛋白质表达分析,通过hibit标签的表达,当缺失特定抗体时,可以实现蛋白质表达定量。可以通过传统方法(例如蛋白质印迹或免疫荧光)以及在荧光素酶二元报道器系统中分析蛋白质表达,从而可以使用板读取器进行可靠且快速的相对表达定量。
人类心脏发展期间的转录网络
摘要:人类心脏发育由控制动态和时间基因表达改变的转录因子(TF)网络控制。因此,为了全面地表征这些转录法规,在整个定向的心脏差异中产生了日常转录组素,从三种不同的人类诱导的多能干细胞系中,来自健康的供体(32天)。我们将基于表达的相关评分应用于TF基因的时间顺序表达式,并将它们聚集到12个顺序基因表达波中。然后,我们确定了一个超过23,000个激活和抑制链接的调节网络。在该网络中,我们观察到以前未知的推断转录激活将IRX3和IRX5 TF连接到三个主心脏TFS:GATA4,NKX2-5和TBX5。荧光素酶和共免疫沉淀分析表明,这些五个TF可以(1)激活彼此的表达; (2)物理相互作用作为多蛋白复合物; (3)共同调节SCN5A的表达,编码主要的心脏钠通道。总的来说,这些结果揭示了TF之间的数千种相互作用,从而产生了统治人类心脏发展的多种强大假设。
2024 年美国癌症研究学会年会
TEAD 转录因子已成为 Hippo 变异癌症(例如由 NF2 失活/缺陷引起的间皮瘤)的临床验证靶点。我们开发了一系列新型小分子靶向 TEAD 蛋白质降解剂,这些降解剂基于 TEAD 界面 3 的结合剂。在细胞中,这些化合物通过与 Cereblon 形成三元复合物来诱导 TEAD 降解,从而导致 TEAD 泛素化和随后的蛋白酶体降解。在基于细胞的荧光素酶报告基因测定中,降解剂显示出低纳摩尔活性。通过对真正的 YAP-TEAD 靶基因(例如 CTGF、Cyr61 和 AMOTL2)进行 qPCR 分析,进一步研究了 TEAD 降解的下游效应。通过使用各种间皮瘤细胞系进行细胞活力和增殖测定,将 TEAD 降解剂的有效性与其他类别的 TEAD 调节剂(如棕榈酰化和 YAP–TEAD 蛋白质相互作用抑制剂)进行了比较。最后,我们通过将一种选定的 TEAD 降解剂与约 2,800 种肿瘤药物库相结合,进行了无偏、定量的高通量药物组合筛选 1。
MicroRNA-200c 通过靶向上皮间质转换调节因子 ZEB2 抑制三阴性乳腺癌的转移
摘要 .目的 .三阴性乳腺癌(TNBC)是女性最常见的恶性、高度异质性肿瘤之一。miR-200c等微小RNA(miRNA)在包括TNBC在内的多种恶性肿瘤中发挥重要作用。但miRNA-200c在TNBC中的生物学作用尚不十分清楚。本研究探讨miR-200c在TNBC生长中的作用机制。方法 .采用逆转录定量聚合酶链式反应检测TNBC组织和TNBC细胞中miR-200c的表达。细胞计数试剂盒8(CCK-8)实验、划痕愈合实验和transwell实验分别观察miR-200c对TNBC细胞增殖、迁移和侵袭的影响。用Western印迹法检测上皮间质转化(EMT)标志物的表达。使用双荧光素酶报告基因检测来测试 ZEB2 是否是 miR-200c 的新靶点。结果。我们的结果表明 ZEB2 是 miR-200c 的新靶点,并且 ZEB2 通过 EMT 介导三阴性乳腺癌的转移。结论。miR-200c 通过靶向 ZEB2 来减弱 TNBC 细胞侵袭和 EMT。因此,我们的数据表明 miR-200c 可用于开发新的 TNBC 早期诊断和治疗策略。
CRISPRATER:具有CRISPR技术的哺乳动物细胞自动基因调节的生物分子电路
图1 - 反思积分控制器和强大的完美适应。a)反思积分控制器是一个负反馈回路(闭环),其中组成型表达的激活剂物种X驱动了感兴趣的Z(输出)的表达。z驱动抑制剂y的表达,该抑制剂y结合并抑制X。当z的浓度变化时,y也会导致x以相反的方式变化(例如如果z的浓度降低,则活性x将增加,反之亦然)。该机制使反思积分控制器在扰动(红线)面对面的Z(实心橙色线)的浓度(固体橙色线)(红线),从而使Z恒定随着时间的推移保持恒定。在开放环配置中,Z是从组成型启动子直接表达的,如果由于外部扰动(红线)而其浓度降低(红线),其浓度随着时间的流逝不会恒定(虚线橙色线)。b)我们实施中的物种本身就是转录激活剂,并且可以通过将发光萤火虫荧光素酶(FLUC)放置在由Z驱动的启动子下,或直接将EGFP Pluorescent Reporter融合到Z本身的启动子中,可以间接地跟踪其浓度。
e-guard:专家指导的鲁棒干扰复合检测
由小有机化合物引起的分析干扰继续对早期药物发现构成巨大挑战。已经开发了各种计算方法来识别可能引起测定干扰的化合物。但是,由于可用于模型开发的数据稀缺,这些方法的预测准确性和适用性受到限制。在这项工作中,我们介绍了E-Guard(专家指导的鲁棒干扰复合检测的增强),这是一个新颖的框架,试图通过整合自我介绍,积极的学习和专家指导的分子产生来解决数据稀缺和失衡。e-guard迭代地用与干扰相关的分子丰富了训练数据,从而产生了具有出色性能的定量结构交流关系(QSIR)模型。我们以四个高质量数据集,氧化还原反应性,纳米酸酯酶抑制和萤火虫荧光素酶抑制的示例,证明了电子方形的实用性。与未经e-Guard数据增强的模型相比,这些数据集的MCC值最高为0.47,其富集因子的改进有两个或更高。这些结果突出了电子保守物作为缓解早期药物发现中测定干扰的可扩展解决方案的潜力。
DigitalCommons@TMC——德克萨斯医疗中心
肿瘤坏死因子受体相关蛋白 1 (TRAP1) 是 HSP90 分子伴侣的线粒体同源物。它通过调节活性氧化物质 (ROS) 在防止氧化应激和细胞凋亡方面发挥重要作用。为了进一步阐明 TRAP1 在调节肿瘤细胞存活中的机制作用,我们使用了加米替尼-三苯基膦 (G-TPP) 来抑制结肠癌中的 TRAP1 信号通路。G-TPP 抑制 TRAP1 会破坏氧化还原稳态并诱导细胞死亡。然而,结肠癌通过诱导不同的 ER 应激反应和 ROS 积累,对 G-TPP 治疗表现出广泛的反应。有趣的是,使用 GSE106582 数据库观察到结肠肿瘤组织中 TRAP1 和抗氧化剂基因表达之间存在强烈的负相关性。使用荧光素酶报告基因检测,我们检测到 G-TPP 处理的 DLD1 和 RKO 细胞中抗氧化反应元件 (ARE) 的转录激活增加,但在 SW48 细胞中没有。我们发现 G-TPP 诱导 G-TPP 敏感细胞 (SW48) 中 GRP78、CHOP 和 PARP 裂解上调。相反,G-TPP 处理 G-TPP 抗性细胞 (DLD1 和 RKO) 导致过度
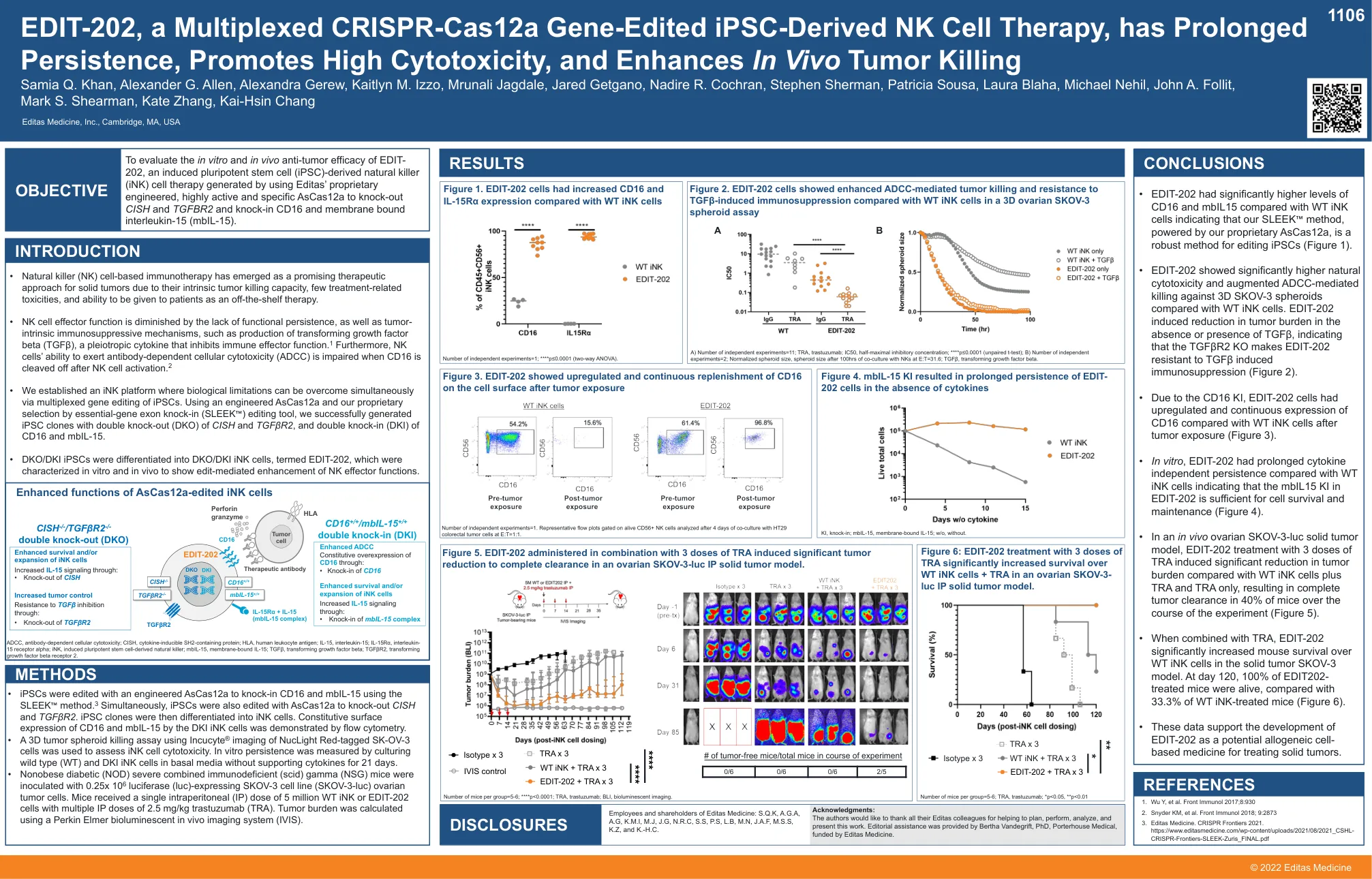
EDIT-202,一种多路复用 CRISPR-Cas12a 基因......
• 使用 SLEEK ™ 方法,用工程化的 AsCas12a 编辑 iPSC,敲入 CD16 和 mbIL-15。3 同时,还用 AsCas12a 编辑 iPSC,敲除 CISH 和 TGFβR2。然后将 iPSC 克隆分化为 iNK 细胞。流式细胞术证明 DKI iNK 细胞表面表达 CD16 和 mbIL-15。• 使用 Incucyte ® 成像 NucLight Red 标记的 SK-OV-3 细胞进行 3D 肿瘤球体杀伤试验,以评估 iNK 细胞的细胞毒性。通过在基础培养基中培养野生型 (WT) 和 DKI iNK 细胞 21 天(不含支持细胞因子)来测量体外持久性。 • 非肥胖糖尿病 (NOD) 严重联合免疫缺陷 (scid) γ (NSG) 小鼠接种 0.25x 10 6 荧光素酶 (luc) 表达 SKOV-3 细胞系 (SKOV-3-luc) 卵巢肿瘤细胞。小鼠接受单次腹膜内 (IP) 剂量 500 万 WT iNK 或 EDIT-202 细胞,多次 IP 剂量 2.5 mg/kg 曲妥珠单抗 (TRA)。使用 Perkin Elmer 生物发光体内成像系统 (IVIS) 计算肿瘤负荷。披露
e-guard:专家指导的鲁棒干扰复合检测
由小有机化合物引起的分析干扰继续对早期药物发现构成巨大挑战。已经开发了各种计算方法来识别可能引起测定干扰的化合物。但是,由于可用于模型开发的数据稀缺,这些方法的预测准确性和适用性受到限制。在这项工作中,我们介绍了E-Guard(专家指导的鲁棒干扰复合检测的增强),这是一个新颖的框架,试图通过整合自我介绍,积极的学习和专家指导的分子产生来解决数据稀缺和失衡。e-guard迭代地用与干扰相关的分子丰富了训练数据,从而产生了具有出色性能的定量结构交流关系(QSIR)模型。我们以四个高质量数据集,氧化还原反应性,纳米酸酯酶抑制和萤火虫荧光素酶抑制的示例,证明了电子方形的实用性。与未经e-Guard数据增强的模型相比,这些数据集的MCC值最高为0.47,其富集因子的改进有两个或更高。这些结果突出了电子保守物作为缓解早期药物发现中测定干扰的可扩展解决方案的潜力。