XiaoMi-AI文件搜索系统
World File Search System辉瑞管道
● 本报告包含前瞻性陈述,这些陈述受重大风险和不确定性的影响,可能导致实际结果与这些陈述所表达或暗示的结果大不相同。对于管道产品,无法保证临床研究会成功,产品会获得必要的监管批准,或产品会证明具有商业成功。如果基本假设被证明不准确或风险或不确定性成为现实,实际结果可能与前瞻性陈述中所述或暗示的结果大不相同。有关这些因素和其他因素的更多信息,可在辉瑞截至 2022 年 12 月 31 日的财政年度的 10-K 表年度报告及其后续的 10-Q 表报告中找到,包括其中标题为“风险因素”和“前瞻性信息和可能影响未来结果的因素”的章节,以及我们后续的 8-K 表报告,所有这些报告均已提交给美国证券交易委员会,可在 www.sec.gov 和 www.pfizer.com 上查阅。
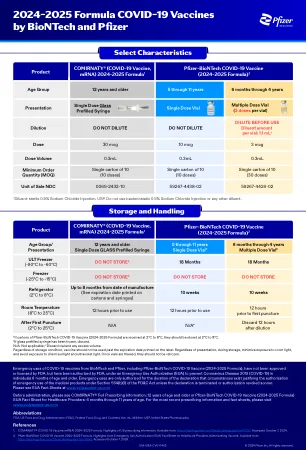
BioNTech 和辉瑞公司 2024-2025 年新冠疫苗配方
BioNTech 和辉瑞的 COVID-19 疫苗(包括辉瑞-BioNTech COVID-19 疫苗(2024-2025 配方))的紧急使用尚未获得 FDA 批准或许可,但已获得 FDA 的紧急使用授权 (EUA),用于预防 6 个月及以上人群的 2019 年冠状病毒病 (COVID-19)。除非声明提前终止或授权被撤销,否则紧急使用仅在声明存在证明根据《联邦食品、药品和化妆品法案》第 564(b)(1) 条授权紧急使用医疗产品的情况期间内获得授权。请参阅 www.cvdvaccine-us.com 上的 EUA 情况说明书
分布式生物宣布与辉瑞公司的超人平台许可协议
包括一个团队,包括抗体曲目测序技术的发明者,其废物抗体和TCR曲目分析和工程平台,使合作伙伴能够通过高通量序列,sanger序列,sanger序列以及功能性测定而无需大型数据中心投资或本地BioInormististics或本地生物学专业人士来分析抗体库库。通过使用BeNESIS分析数千种抗体库和抗体库,他们开发了计算优化的超人人类抗体发现平台。超人克服了其他单克隆生成技术的许多局限性,具有前所未有的多样性和可开发的健身性,这导致了独特的工程机会:一个库对每种抗原测试的库产生5000多个独特的命中,包括数百种独特的Picolor型Picormolt,包括数百种独特的Picolor粘合剂,以抗PD1和GHR等有挑战性的目标。鉴于命中率的数量,该文库可以在前所未有的侵略性条件下放置,在一周的时间内恢复了数百个亚纳摩尔粘合剂,恢复了针对每个表位的饱和击球覆盖范围,并在没有其他工程的情况下将多种特种交叉反应成员隔离。
与辉瑞的Covid-19
“Please provide the following information 1) all internal communications and analysis including meeting minutes, within DPMC about disinformation and misinformation including where these terms came from and when and how they should be used in the context of Covid or the PfizerVax 2) all external communications, advise and analysis between any representative of DPMC and any Minister, other government department, university entity or any researcher, media representative or other person about disinformation and misinformation including where these terms came from and when and how they should be used in the contexts of Covid or the PfizerVax 3) any reflection or analysis, meeting minutes, or other information about the legality or otherwise of labelling or trying to shame New Zealanders and/ or otherwise close down questioning of government Covid or vaccine policy, even after: a) it became patently obvious that the vaccine did not prevent infection, transmission, hospitalisation or reinfection so was not effective in the commonly理解的意义和/或b)显而易见,它可能会造成严重的不良影响甚至死亡,包括心肌炎,心包炎,血管炎,血管炎,凝结以及其他效果以及其他效果以及其他效果和安全信号和安全信号,Medsafe,Medsafe的顾问,CTAG委员会,CTAG委员会,CTAG委员会,ISMB,Coroner,Coroner和其他International Assors和其他步骤的信息以及其他任何步骤,以了解某些步骤和其他步骤。毛利人和c)公众对Pfizervax的风险以及缺乏纠正政府“安全有效”造成的误导印象的有效性,并为您的Whanau“媒体”运动
辉瑞管道
● 本报告包含前瞻性陈述,这些陈述受重大风险和不确定性的影响,可能导致实际结果与此类陈述明示或暗示的结果存在重大差异。对于管道产品,无法保证临床研究会成功,产品会获得必要的监管批准,或证明它们会在商业上取得成功。如果基本假设被证明不准确或风险或不确定性成为现实,实际结果可能与前瞻性陈述中的结果存在重大差异。有关这些因素和其他因素的更多信息,可在辉瑞截至 2021 年 12 月 31 日财年的 10-K 表年度报告及其后续 10-Q 表报告中找到,包括其中标题为“风险因素”和“前瞻性信息和可能影响未来结果的因素”的部分,以及我们后续的 8-K 表报告,所有这些报告均已提交给美国证券交易委员会,可在 www.sec.gov 和 www.pfizer.com 上查阅。
辉瑞管道
PF-06940434 整合素 alpha-V/beta-8 拮抗剂 实体瘤(生物制剂) 第 1 阶段 新 分子实体 PF-07209960 白细胞介素 15 (IL15) 激活剂 实体瘤(生物制剂) 第 1 阶段 新 分子实体 PF-07220060 CDK4 抑制剂 乳腺癌转移性 第 1 阶段 新 分子实体 PF-07265807 AXL/MERTK 抑制剂 实体瘤 第 1 阶段 新 分子实体 PF-07104091 CDK2 抑制剂 乳腺癌转移性 第 1 阶段 新 分子实体 PF-07248144 KAT6A 表观遗传修饰剂 乳腺癌转移性 第 1 阶段 新 分子实体 PF-07284890 BRAF BP 激酶抑制剂 黑色素瘤 第 1 阶段 新分子实体 PF-07284892 SHP2 酪氨酸磷酸酶抑制剂 癌症 第 1 期 新 分子实体 PF-07257876 CD47xPDL1 双特异性 NSCLC(生物制剂) 第 1 期 新 分子实体 PF-07263689 OBIR-2 治疗性疫苗 实体瘤(生物制剂) 第 1 期 新 分子实体 PF-07260437 B7H4-CD3 双特异性 乳腺癌 转移性(生物制剂) 第 1 期 新 分子实体 PF-07265028 HPK1 抑制剂 实体瘤 第 1 期 新 分子实体 PF-07104091 + PF-07220060 CDK2 + CDK4 抑制剂 乳腺癌 转移性 第 1 期 新 分子实体 ► PF-07104091 + Ibrance CDK2 + CDK4/6 抑制剂乳腺癌转移性 I 期产品增强
FDA-辉瑞
2022 年 5 月 27 日,辉瑞向 FDA 提交了一份请求,要求修改辉瑞-BioNTech COVID-19 疫苗 (BNT162b2) 的紧急使用授权 (EUA),用于预防由严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 引起的 2019 冠状病毒病 (COVID-19)。该修正案将扩大 BNT162b2 的用途,包括 3 剂初级系列 (每剂 3 µg),用于 6 个月至 4 岁的婴儿和儿童。辉瑞在其请求中提交了正在进行的随机、双盲、安慰剂对照试验 C4591007 的安全性、免疫原性和初步描述性功效数据。6 个月至 4 岁的受试者按 2:1 的比例随机分配接受 2 剂 BNT162b2(每剂 3 µg mRNA)或盐水安慰剂,间隔 3 周给药。在分析了第 2 剂后的安全性和有效性数据后,对方案进行了修改,在第 2 剂后至少 8 周对 6 个月至 4 岁的参与者施用第三个主要系列剂量。 EUA 请求包括 1,178 名 BNT162b2 接受者和 598 名 6 个月至 23 个月(以下简称 6-23 个月)年龄的安慰剂接受者的 2/3 期安全性数据;以及 1,835 名 BNT162b2 接受者和 915 名 2 岁至 4 岁(以下简称 2-4 岁)年龄的安慰剂接受者,他们至少接受了一剂研究产品。在 2022 年 4 月 29 日数据截止时,在 6 个月至 4 岁的参与者中,中位随访时间为第 3 剂后 2.1 个月(包括盲法和开放标签随访)。在研究 C4591007 中,疫苗有效性是根据 SARS-CoV-2 50% 中和抗体滴度 (NT50,SARS-CoV-2 mNG 微量中和试验) 通过免疫桥接推断的。在进一步划分的两个年龄组 (6-23 个月和 2-4 岁) 中,将第 3 剂后 1 个月的中和抗体滴度与第 2 剂后 1 个月的滴度进行比较,这些中和抗体滴度来自在 2/3 期功效研究 C4591001 中已接受两剂 30 μg BNT162b2 的 16-25 岁随机选择的参与者子集。还提供了对接受 3 次研究疫苗接种的参与者的疫苗有效性 (VE) 的初步描述性分析 (在第 3 剂后至少 7 天内累计出现 10 例确诊的 COVID-19 病例)。主要免疫原性终点是评估在第 3 剂后 1 个月内无 SARS-CoV-2 感染证据的参与者中,通过微量中和试验评估针对 USA_WA1/2020 参考毒株(武汉样毒株)的中和抗体滴度。按照以下顺序对 6-23 个月和 2-4 岁年龄组中的每个年龄组依次测试免疫桥接终点和统计成功标准:•在研究 C4591007 中测量的第 2/3 期 6-23 个月参与者的第 3 剂后 1 个月的 SARS-CoV-2 中和抗体几何平均滴度(GMT),与在研究 C4591001 中随机选择的 16-25 岁参与者子集中测量的第 2 剂后 1 个月的 GMT,免疫桥接成功标准为 GMT 比率(儿童年龄组/16-25 岁)95% 置信区间 (CI) 下限 >0.67,GMT 比率的点估计值≥1.0。• 血清反应率(SARS-CoV-2 中和抗体滴度较第 1 剂前基线上升≥4 倍的参与者百分比),免疫桥接成功标准为血清反应率差异(儿童年龄组减去 16-25 岁)95% CI 下限 >−10%。如上所述,两个年龄组均符合免疫桥接统计成功标准。与基线时有 SARS-CoV-2 感染证据的两个年龄组参与者相比,第 3 剂后中和抗体 GMT 在数值上更高
赞助商(辉瑞)
预防性辉瑞-BioNTech COVID-19 疫苗 (BNT162b2) 自 2020 年 12 月起已根据紧急使用授权 (EUA 27034;2020 年 12 月 11 日) 在美国上市,用于预防 2019 年冠状病毒病 (COVID-19),作为 16 岁以上人群的两剂基础系列疫苗。EUA 的修正案于 2021 年 4 月 9 日提交给 FDA,并于 2021 年 5 月 10 日获得授权,以支持作为 12 岁以上人群的两剂基础系列疫苗紧急使用。 2021 年 9 月 22 日,美国政府批准了针对 1 岁以上高危人群(1 ≥18 岁)的单剂加强剂紧急使用授权。2021 年 8 月 23 日,美国政府批准了一项生物制品许可申请 (BLA),允许对 16 岁以上人群进行 30 µg BNT162b2 两剂基础系列接种。截至 2021 年 8 月 31 日,全球已分发了约 14 亿剂 BNT162b2。
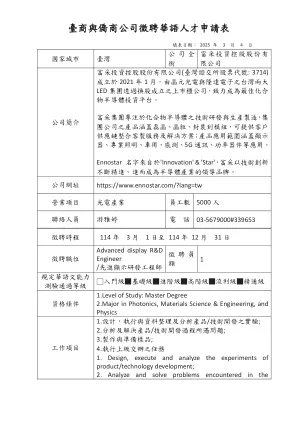
台商与侨商公司征聘华语人才申请表
3。负责新产品制程的导入,并进行制程的检测定期检测制程设备的重点参数。5。持续改善现有生产制程。6。调查并处理生产制程的异常状况。7。负责技术文件之撰写与维护。8。负责每日产量及良率的分析、监控及改善。9。推行生产制程的相关教育训练计划。1。制定制造程序和产品标准。2。评估过程项目计划并制定最合适的制造过程。3。负责引入新产品制造过程和过程测试,以便可以稳定生产新产品并符合相关标准。4。定期测试过程设备的关键参数。5。不断改善现有的生产过程。6。在生产过程中调查并处理异常条件。7。负责撰写和维护技术文档。8。负责分析,监视和改善每日产量和产量。9。实施与生产过程有关的教育和培训计划。