XiaoMi-AI文件搜索系统
World File Search System利用双特异性抗体将 LNP 与细胞表面标志物结合,实现靶向 mRNA 递送
摘要 将 mRNA-LNP 有效递送至特定细胞类型仍然是 mRNA 疗法广泛应用过程中面临的主要挑战。传统的靶向方法包括修改脂质组成或对脂质纳米颗粒 (LNP) 的表面进行功能化,这会使制造变得复杂,改变纳米颗粒的大小、电荷和隐身性,影响其递送和免疫原性。在这里,我们提出了一种通用的靶向 mRNA-LNP 递送方法,该方法使用双特异性抗体 (BsAbs) 在 LNP 和细胞表面标志物之间建立桥梁。不是将靶向剂附着到纳米载体上,而是先施用 BsAbs,与靶细胞上的表面蛋白结合,然后将未修饰的 LNP 保留在受影响的组织中。我们证明了在体外和体内将 mRNA-LNP 有效且细胞类型特异性地递送至表皮生长因子受体 (EGFR) 和叶酸水解酶 1 (PSMA) 阳性细胞。该技术的灵活性是通过替换 BsAbs 的细胞靶向区域实现的,从而使得下一代靶向 mRNA 药物能够快速开发。
优化靶向基因递送
与经典药物相比,基因治疗有可能介导可能的最高治疗水平。每个正常或患病的细胞都可以通过使用仅在给定独特情况下活跃的特定转录因子来打开或关闭组织,疾病和时间依赖性方式的基因表达盒。实际上,我们在实现概念时面临问题:将核酸递送到靶细胞中是非常无效的,并且提出了巨大的挑战。未来发展的关键问题包括改善靶向,增强的细胞内摄取以及基因载体的毒性降低。当前使用的矢量类具有互补特征,例如,一方面病毒载体的高细胞内效率,另一方面的低免疫原性和更大的非病毒载体的灵活性。病毒和非病毒媒介技术的合并被强调为对未来的令人鼓舞的策略。概念包括化学修饰的病毒载体(“化学病毒”)和类似病毒样系统的合成(“合成病毒”)。用于向媒介发展到人工合成病毒的研究。
电穿孔在人类和兽医肿瘤学中的应用
ire是一种方法,其中EP通过60-100高压(1.5-3 kV)80-100 µs的爆发来诱导渗透细胞死亡。导致这种渗透死亡的细胞机制是由反应性氧的激活,这是由于跨膜离子流动改变导致的细胞内钙的过度蓄积。IRE触发的细胞死亡发生,没有大量的热变暖或热诱导的Tis-Sue损伤(6)。GET方法论是基于产生能够使遗传颗粒(例如质粒)跨越细胞膜的微孔的,以引入负责诱导免疫系统或靶细胞死亡的基因的表达(9)。ect是一种方法,在这种方法中,通过在肿瘤组织上应用高压电场在局部或系统上的施用,以促进肿瘤细胞对抗肿瘤药物的渗透率(10)。已经提出了几种不同的电程。在图1a,b,c中描绘了最多采用的ECT电场。最常用的细胞毒性化学治疗剂是博来霉素,同样
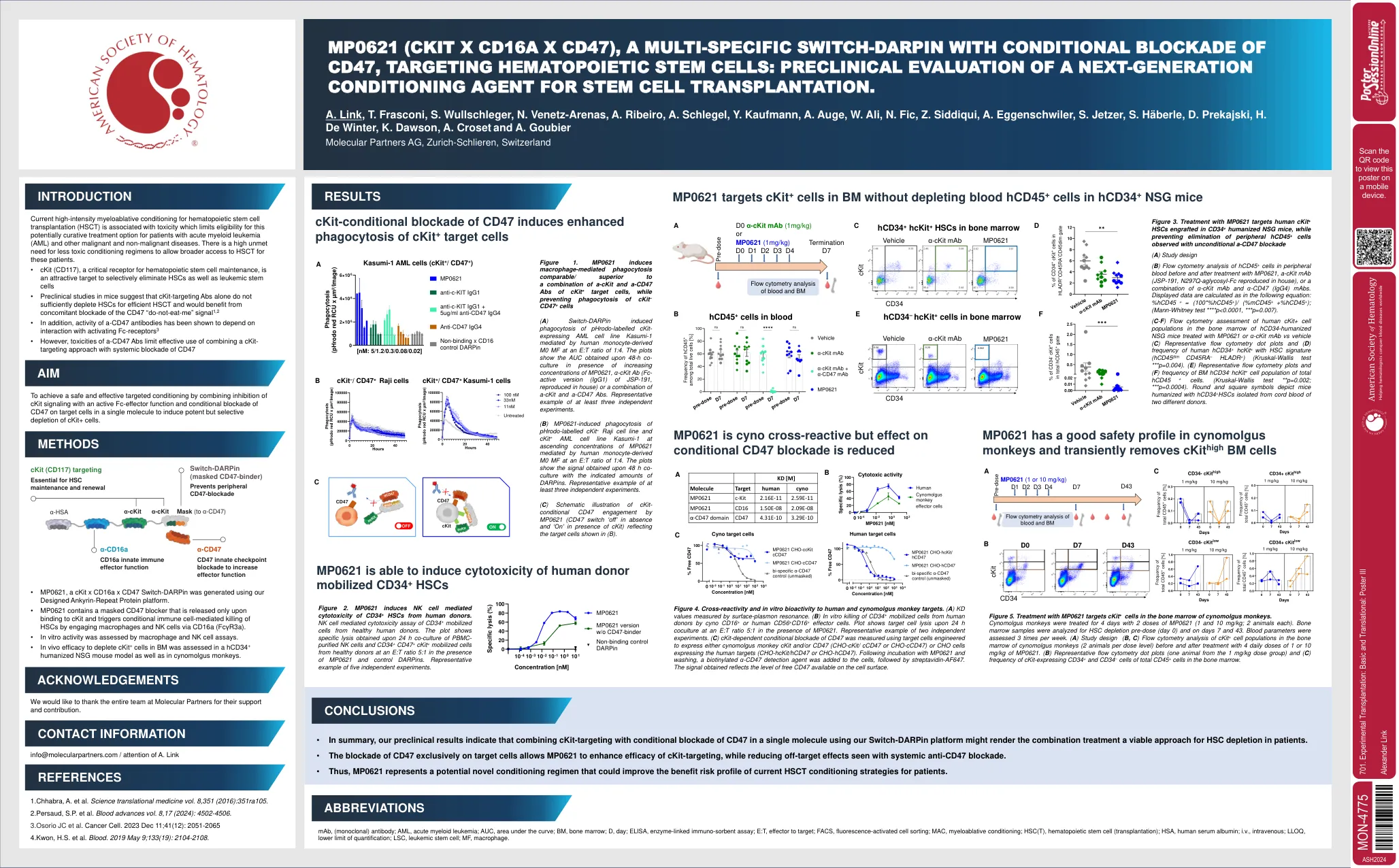
701。实验移植:基本和翻译
图4。交叉反应性以及对人和cynomolgus猴子靶标的体外生物活性。(a)KD值通过表面播种共振测量。(b)通过CYNO CD16 +或人类CD56 + CD16 +效应细胞从人类供体中动员细胞中CD34 +动员细胞的体外杀死。图显示了在MP0621存在的情况下以E:T比5:1的24 h共培养时的靶细胞裂解。两个独立实验的代表性示例。(c)使用工程设计的目标细胞测量CD47的CKIT依赖性条件阻滞,以表达cynomolgus猴子CKIT和/或CD47(CHO-CKIT/CCD47或CHO-CCD47或CHO-CCD47)或CHO CHO细胞表达人类靶标(CHO-HCKIT/HCKIT/HCKD/HCD47或CHO-HCD47)。与MP0621和洗涤孵育后,将生物素化的α-CD47检测剂添加到细胞中,然后将链霉亲和素AF647添加到细胞中。获得的信号反映了细胞表面上可用的游离CD47的水平。
间充质干细胞衍生的人类疾病的细胞外囊泡
抽象的干细胞疗法是一种治疗各种严重疾病的新方法,包括自身免疫性疾病,器官移植,肿瘤和神经退行性疾病。尽管如此,干细胞的广泛利用受到潜在的肿瘤性,精确分化的挑战,排斥关注和道德考虑。细胞外囊泡具有从干细胞中携带多种生物活性因子并将其输送到特定靶细胞或组织的能力。此外,它们提供了低免疫原性的优势。因此,它们有可能促进干细胞的治疗潜力,从而减轻与直接干细胞应用相关的风险。因此,在临床疾病中使用干细胞细胞外囊泡已受到越来越多的关注。本综述总结了使用间充质干细胞(MSC)使用细胞外囊泡的进步。MSC细胞外囊泡用于治疗炎性疾病,例如类风湿关节炎,肝损伤,Covid-19和过敏;在修复心脏病,肾脏损伤和骨关节炎疾病中的组织损伤中;作为治疗肿瘤的携带者;作为
carvykti
背景Carvykti(Ciltacabtagene Autoleucel)是B细胞成熟抗原(BCMA)指导的,转基因自体T细胞免疫疗法,涉及将患者自身的T细胞重新编程,并用经过嵌合的嵌合抗原受体(CAR)来识别和消除BCCA的嵌合抗原受体(CAR),以表达BCMA。与表达BCMA的细胞结合后,CAR促进了T细胞激活,扩张和消除靶细胞(1)。调节状态FDA批准的指示:CARVYKTI是B细胞成熟抗原(BCMA)指导的遗传修饰的自体T细胞免疫疗法,以治疗成年患者的复发或耐火多发性多发性骨髓瘤,至少接受了1次先前的疗法,包括蛋白酶的蛋白酶,包括蛋白酶蛋白酶蛋白酶,及其蛋白酶蛋白酶蛋白酶,及其蛋白酶蛋白酶蛋白酶蛋白酶蛋白疗法及其蛋白酶蛋白酶蛋白酶蛋白酶及其蛋白酶蛋白酶素及其蛋白酶蛋白酶素及其蛋白酶反射剂及其蛋白酶反射剂及其抑制作用。 Lenalidomide(1)。CARVYKTI已发出有关:(1)
基于 CRISPR-Cas9 的基因组工程...
(Doudna 和 Charpentier,2014 年)并在图 1a 中以示意图形式显示。许多细菌物种都有 CRISPR 和 Cas 基因座的变体,其中作为基因组编辑工具研究最广泛的变体是 CRISPR-Cas9 系统(Makarova 等人,2011 年)。CRISPR-Cas9 介导的基因组编辑需要一个 Cas9 引导 RNA(gRNA)复合物,其中包含 Cas9、CRISPR RNA(crRNA)和反式激活 CRISPR RNA(tracrRNA)(见框 1:CRISPR 术语)。如前所述,可以通过多种方法将该复合物引入靶细胞(Lino 等人,2018 年;Shi 等人,2021 年)。在 crRNA 的引导下,该复合物与补体 DNA 结合,并伴有侧翼的原始间隔区相邻基序 5 0 -NGG-3 0(对于化脓性链球菌 Cas9)( Chylinski 等人,2013)。Cas9-gRNA 复合物在靶位点诱导双链断裂( Deltcheva 等人,2011;Shah 等人,2013),靶细胞可以通过非同源末端连接 (NHEJ)( Hefferin 和 Tomkinson,2005)或同源定向修复 (HDR)( Liang 等人,1998)进行修复。在 NHEJ 中,断裂的 DNA 链被重新连接,可以直接重新连接,也可以在随机核苷酸插入或缺失后重新连接( Takata 等人,1998)。这通常会导致移码突变和过早的终止密码子,因此,这种机制很容易用于敲除目的蛋白的表达。在 HDR 中,双链断裂是使用姐妹染色单体作为同源模板链来修复的。通过多次交换、DNA 合成和连接,受损链可以得到精确修复(Takata 等,1998)。不用姐妹染色单体作为模板链,而是将含有所需突变或基因盒的外源 DNA 模板以单链或双链 DNA 的形式引入,同源臂在外侧(Chen 等,2011;Radecke 等,2010;Rouet 等,1994)。多年来,越来越多的实验皮肤病学领域的研究利用了 CRISPR-Cas9 工具箱,尽管目前的数量有限,但在过去 5 年中有所增加(图 1 b 和 c 以及表 1)。本综述旨在认识到在人类表皮角质形成细胞 (KC) 中进行的所有 CRISPR-Cas9 工作,以确定在不同人类 KC 细胞来源中可用的最佳实践和成功策略的关键决定因素,同时为未来使用 CRISPR-Cas9 进行研究提供关键考虑,无论是基础应用还是临床应用。
利用内皮唾液酸蛋白 (...) 针对活化的微环境
摘要 背景 由于缺乏合适的肿瘤特异性抗原,以及免疫抑制和促纤维化肿瘤微环境阻碍了 CAR-T 细胞的浸润、活性和持久性,嵌合抗原受体 (CAR)-T 细胞靶向实体癌的应用受到限制。我们假设,靶向由肿瘤相关周细胞和血管周围癌症相关成纤维细胞强烈表达的内皮唾液酸蛋白 (CD248) 受体将避免这些挑战,并为 CAR-T 细胞疗法提供令人兴奋的抗原,因为靶细胞与肿瘤血管距离很近,正常组织中内皮唾液酸蛋白表达有限,并且内皮唾液酸蛋白敲除小鼠缺乏表型。方法我们从三种免疫活性小鼠品系 BALB/c、FVB/N 和 C57BL/6 中生成了内皮唾液酸蛋白靶向的 E3K CAR-T 细胞。评估了 E3K CAR-T 细胞组成(CD4 + / CD8 + 比例)、体外对内皮唾液酸 + 和内皮唾液酸 – 细胞的活性,以及在同源肿瘤模型以及未接受肿瘤治疗的健康和受伤小鼠和携带肿瘤的内皮唾液酸基因敲除小鼠中的体内扩增和活性。结果 E3K CAR-T 细胞在体外对小鼠和人类内皮唾液酸 + 细胞均有活性,但对内皮唾液酸 – 细胞无活性。过继转移的 E3K CAR-T 细胞在内皮唾液酸基因敲除小鼠、未接受肿瘤治疗的内皮唾液酸野生型小鼠或伤口愈合模型中均无活性,表明不存在脱靶和在靶/脱肿瘤活性。相比之下,将 E3K CAR-T 细胞过继转移到携带同基因乳腺癌或肺癌系的 BALB/c、FVB/N 或 C57BL/6 小鼠体内,会耗尽肿瘤基质中的靶细胞,导致肿瘤坏死增加、肿瘤生长减缓和转移性生长显著受损。结论这些数据共同强调了内皮唾液酸蛋白是 CAR-T 细胞疗法的可行抗原,并且靶向与肿瘤血管密切相关的基质细胞可避免 CAR-T 细胞不得不在严酷的免疫抑制肿瘤微环境中生存。此外,E3K CAR-T 细胞识别和靶向小鼠和人内皮唾液酸蛋白 + 细胞的能力使人性化和优化的 E3K CAR 成为适用于多种实体瘤类型临床开发的有希望的候选药物。
靶向聚合物胶束系统,旨在携带L-天冬酰胺酶和阿霉素的组合货物,显示出细胞毒性疗效的巨大改善
摘要:L-天冬酰胺酶(ASP)和阿霉素(DOX)均用于白血病的治疗,包括组合。我们试图调查它们在同一目标递送工具中是否可以使这种治疗更加有效。我们组装了一个胶束系统,其中内部疏水核心装有DOX,而ASP由于静电相互作用而在表面吸收。为了使这种吸收更强,我们与肝素 - 乳酸和油酸的少精胺和诸如精子和脂质成分的寡胺结合了肝素。与游离DOX相比,单独使用DOX时,系统的细胞毒性提高了约10倍。ASP仅显示细胞毒性增加了2.5倍,因此,假设效应的添加性,当两种药物结合使用时,人们可能会预计会提高25倍。 但实际上,加载到输送系统中的ASP + DOX的组合产生了一种协同作用,具有50倍的改进与免费的单个组件。 药代动力学研究表明,血液中胶束制剂的循环延长,以及胶束形式中DOX的有效浓度的增加,DOX降低了DOX对肝脏和心脏的积累(这降低了肝毒性和心脏毒性)。 出于相同的原因,DOX的脂质体配方一直用于治疗多种类型的癌症,几乎取代了免费药物。 我们认为,将两种类型的药物结合到同一靶细胞可能是朝着改善癌症治疗中的风险 - 抗抗性比的进一步步骤。ASP仅显示细胞毒性增加了2.5倍,因此,假设效应的添加性,当两种药物结合使用时,人们可能会预计会提高25倍。但实际上,加载到输送系统中的ASP + DOX的组合产生了一种协同作用,具有50倍的改进与免费的单个组件。药代动力学研究表明,血液中胶束制剂的循环延长,以及胶束形式中DOX的有效浓度的增加,DOX降低了DOX对肝脏和心脏的积累(这降低了肝毒性和心脏毒性)。出于相同的原因,DOX的脂质体配方一直用于治疗多种类型的癌症,几乎取代了免费药物。我们认为,将两种类型的药物结合到同一靶细胞可能是朝着改善癌症治疗中的风险 - 抗抗性比的进一步步骤。
近红外光免疫疗法
摘要:近红外光免疫疗法 (NIR-PIT) 是一种新开发的分子靶向癌症治疗方法,通过施用与 IRdye700 结合的癌症靶向部分选择性地杀死癌细胞或免疫调节细胞并诱导治疗宿主免疫反应。局部暴露于近红外 (NIR) 光会引起光诱导配体释放反应,从而对靶细胞造成损害,导致免疫原性细胞死亡 (ICD),而对周围正常细胞几乎没有副作用。此外,NIR-PIT 可以通过结合靶向 NIR-PIT 的癌细胞和靶向 NIR-PIT 或其他癌症治疗方式的免疫调节细胞,在远处转移中产生免疫反应并抑制进一步的癌症攻击。最近,人们探索了 NIR-PIT 的几项改进,例如导管驱动的 NIR 光传输、癌症的实时监测以及新靶分子的开发,从而使 NIR-PIT 被视为一种有前途的癌症治疗方法。在本综述中,我们讨论了NIR-PIT的进展、其机制和癌症治疗的设计策略。此外,简要总结了NIR-PIT的总体可能靶向分子及其在癌症治疗中的应用。