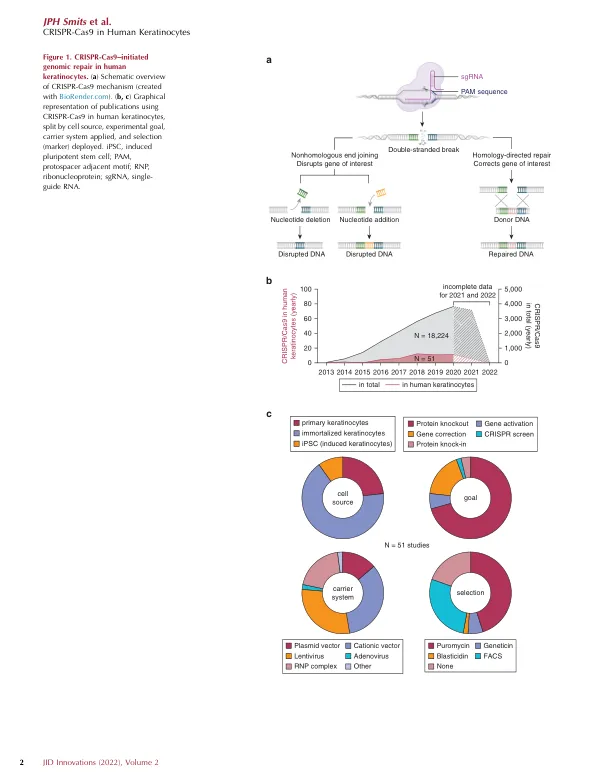
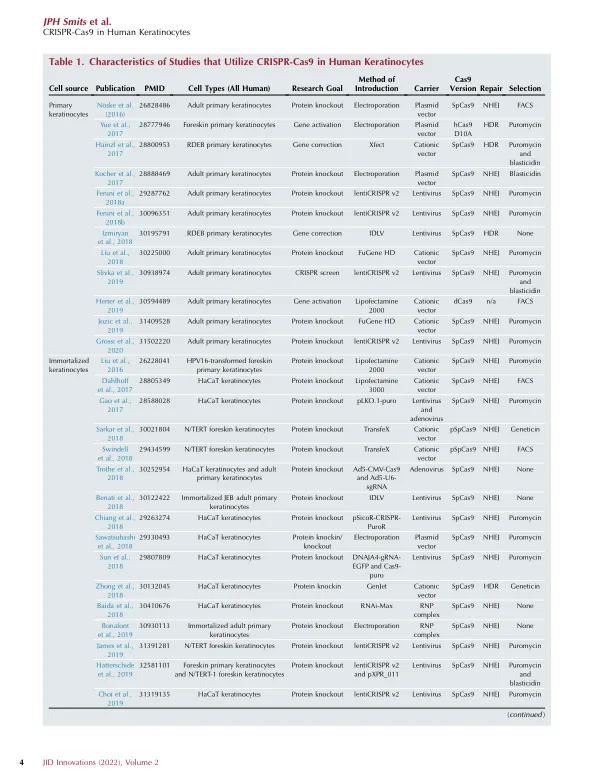
(Doudna 和 Charpentier,2014 年)并在图 1a 中以示意图形式显示。许多细菌物种都有 CRISPR 和 Cas 基因座的变体,其中作为基因组编辑工具研究最广泛的变体是 CRISPR-Cas9 系统(Makarova 等人,2011 年)。CRISPR-Cas9 介导的基因组编辑需要一个 Cas9 引导 RNA(gRNA)复合物,其中包含 Cas9、CRISPR RNA(crRNA)和反式激活 CRISPR RNA(tracrRNA)(见框 1:CRISPR 术语)。如前所述,可以通过多种方法将该复合物引入靶细胞(Lino 等人,2018 年;Shi 等人,2021 年)。在 crRNA 的引导下,该复合物与补体 DNA 结合,并伴有侧翼的原始间隔区相邻基序 5 0 -NGG-3 0(对于化脓性链球菌 Cas9)( Chylinski 等人,2013)。Cas9-gRNA 复合物在靶位点诱导双链断裂( Deltcheva 等人,2011;Shah 等人,2013),靶细胞可以通过非同源末端连接 (NHEJ)( Hefferin 和 Tomkinson,2005)或同源定向修复 (HDR)( Liang 等人,1998)进行修复。在 NHEJ 中,断裂的 DNA 链被重新连接,可以直接重新连接,也可以在随机核苷酸插入或缺失后重新连接( Takata 等人,1998)。这通常会导致移码突变和过早的终止密码子,因此,这种机制很容易用于敲除目的蛋白的表达。在 HDR 中,双链断裂是使用姐妹染色单体作为同源模板链来修复的。通过多次交换、DNA 合成和连接,受损链可以得到精确修复(Takata 等,1998)。不用姐妹染色单体作为模板链,而是将含有所需突变或基因盒的外源 DNA 模板以单链或双链 DNA 的形式引入,同源臂在外侧(Chen 等,2011;Radecke 等,2010;Rouet 等,1994)。多年来,越来越多的实验皮肤病学领域的研究利用了 CRISPR-Cas9 工具箱,尽管目前的数量有限,但在过去 5 年中有所增加(图 1 b 和 c 以及表 1)。本综述旨在认识到在人类表皮角质形成细胞 (KC) 中进行的所有 CRISPR-Cas9 工作,以确定在不同人类 KC 细胞来源中可用的最佳实践和成功策略的关键决定因素,同时为未来使用 CRISPR-Cas9 进行研究提供关键考虑,无论是基础应用还是临床应用。
基于 CRISPR-Cas9 的基因组工程...
主要关键词