XiaoMi-AI文件搜索系统
World File Search System附件 A - 食品药品管理局
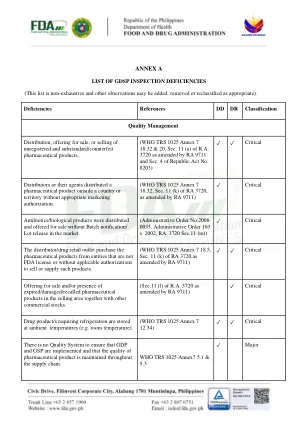
没有制定或书面的采购、储存、分销、配发程序和其他重要的标准操作程序,例如处理投诉、产品退货、召回、疑似假冒/劣质/伪造产品;卫生和害虫防治;处理损坏和/或破损的集装箱;处理溢出物;运输/调查和处理运输过程中任何不符合储存要求的情况;车辆维护;调度;视情况而定。对于所有这些标准操作程序,也没有实施的证据。
国家食品药品监督管理局
a. GHTF/SG1/N71:2012 “‘医疗器械’和‘体外诊断(IVD)医疗器械’术语的定义” GHTF SG1 “医疗器械”和“体外诊断”医疗器械术语的定义 (imdrf.org)
国家食品药品监督管理局 (...
治疗频率 注射用哌拉西林他唑巴坦 USP 4.5 克 每六小时一次 严重肺炎 疑似因细菌感染而发热的中性粒细胞减少症成人 每八小时一次 复杂性尿路感染(包括肾盂肾炎) 复杂性腹腔内感染 皮肤和软组织感染(包括糖尿病足部感染)
国家食品药品监督管理局
头孢泊肟是一种杀菌性头孢菌素类抗生素,可有效对抗多种革兰氏阴性和革兰氏阳性菌。它适用于治疗在感染菌尚未被确认之前或由已知敏感的细菌引起的以下感染。由对头孢泊肟敏感的菌引起的上呼吸道感染,包括鼻窦炎。对于扁桃体炎和咽炎,头孢泊肟应保留用于复发性或慢性感染,或用于已知或怀疑病原菌对常用抗生素有耐药性的感染。由对头孢泊肟敏感的菌引起的下呼吸道感染,包括急性支气管炎、慢性支气管炎复发或加重以及细菌性肺炎。由对头孢泊肟敏感的菌引起的上、下尿路感染,包括膀胱炎和急性肾盂肾炎。由对头孢泊肟敏感的病原体引起的皮肤和软组织感染,如脓肿、蜂窝织炎、感染性伤口、疖、毛囊炎、甲沟炎、痈和溃疡。淋病 - 无并发症的淋菌性尿道炎。
医疗补助食品药品计划
▪ 通常,批准周期为 5 年。▪ 允许各州开展推进医疗补助目标的实验或试点示范项目。▪ 必须得到我们的联邦合作伙伴医疗保险和医疗补助服务中心 (CMS) 的批准。▪ 需要实施和运营计划以及第三方评估。
在美国食品药品管理局面前
7 https://www.softlights.org/wp-content/uploads/2023/08/Response-to-Petition-for-Rulemaking_8-21-23.pdf 8 https://www.softlights.org/wp-content/uploads/2022/10/Baker-CL-2022-0375.pdf 9 https://www.softlights.org/wp-content/uploads/2022/11/CPSC-Jurisdiction-Response.pdf 10 https://www.softlights.org/wp-content/uploads/2022/10/CMS-AX-22-000-1287-Response.pdf 11 https://www.softlights.org/wp-content/uploads/2022/10/Letter-From-OSHA.pdf
食品药品管理局 - 2024 年 12 月
亚当·保罗(Adam Paul)Runsdorf - 38159(5月7日)Angela Maria Giron - 35836(5月2日)布伦登·加格恩PATEL - 11296(2月14日)Kevin Sheng Hsiang Fang - 91408(11月19日)Maria Anzures-Camarena - 46404 - 46404(5月29日)Marina Sievert - 48432 - 48432(6月6日)Martin Valdes - Martin Valdes - 20664(20664) - 20978(3月26日)Richard B. Smith III - 50344(6月13日)Robert Lance Shuffert - 24013(4月5日)Ross Lucien - 11298 - 11298(2月14日)Ryan Stabile - 66413(8月15日IS REED - 20205(3月21日)Yong Sheng Jiao - 96655(12月5日)食品和药物管理现代化法:
食品药品管理局如何批准用于皮肤的外用仿制药?
局部皮肤用药品涵盖多种剂型,包括溶液、凝胶、乳膏、洗剂和软膏等。1984 年《药品价格竞争和专利期恢复法》(公法 98-417),俗称《哈奇-瓦克斯曼修正案》,为仿制药(包括局部皮肤用药品)的审批建立了途径,以增加患者获得此类产品的渠道。经批准的仿制药与预先确定的品牌药品(参考上市药物)在治疗上等效,是已证明生物等效性的药物等效物。当在标签规定的条件下给患者使用时,它们预计具有相同的临床效果和安全性。用于评估此类药品生物等效性的研究类型通常取决于药品的作用部位/机制和剂型的复杂性。
国家食品药品监督管理局安全信号“国家食品药品监督管理局将信号定义为有关不良事件与药品之间可能存在因果关系的报告信息,
SFDA 安全信号 “SFDA 将信号定义为有关不良事件与药物之间可能存在因果关系的报告信息,这种关系之前未知或记录不完整。通常需要一份以上的报告来生成信号,具体取决于事件的严重性和信息的质量。信号是假设,同时包含数据和论据,重要的是要注意信号不仅不确定,而且本质上是初步的” 2022 年 8 月 9 日 沙特食品药品管理局 (SFDA) – 破伤风类毒素 (TT) 疫苗的安全信号和蜂窝织炎风险 沙特食品药品管理局 (SFDA) 建议所有医疗保健专业人员注意与使用破伤风类毒素 (TT) 疫苗相关的蜂窝织炎安全信号。该信号源于常规药物警戒监测活动。 简介
Zydus 宣布获得美国食品药品监督管理局 (FDA) 孤儿药称号……
印度艾哈迈达巴德,2025 年 1 月 22 日 Zydus 是一家领先的、以发现为基础的全球制药公司,今天宣布美国食品药品监督管理局已授予新型口服 NLRP3 抑制剂 Usnoflast 孤儿药资格 (ODD),用于治疗肌萎缩侧索硬化症 (ALS)。美国食品药品监督管理局孤儿药办公室授予孤儿药资格以支持开发用于治疗影响美国不到 200,000 人的罕见疾病的药物。在谈到这一进展时,Zydus Lifesciences Limited 董事长 Pankaj Patel 表示:“美国食品药品监督管理局授予的这一孤儿药资格强调了开发 Usnoflast 以治疗致命的神经退行性疾病肌萎缩侧索硬化症 (ALS) 的迫切需要。Zydus 致力于开拓神经科学的新前沿,并为 ALS 患者开发 Usnoflast。”患有 ALS 的人从确诊到死亡的平均存活期约为 2 至 5 年,大多数 ALS 患者死于呼吸衰竭。ALS 患者会出现神经炎症和快速神经退化。轴突神经退化会导致神经丝形成,这些神经丝首先在 ALS 患者的脑脊液中积聚,然后慢慢进入血液循环。由于快速神经退化,ALS 患者逐渐丧失移动、说话、进食的能力,最终导致呼吸、瘫痪和死亡。根据美国疾病控制和预防中心 (CDC) 的统计数据,ALS 影响了美国约 32,000 人,美国每年平均有 5,000 名新患者被诊断出患有此病。据估计,欧洲(欧盟和英国)有超过 30,000 人患有 ALS,而印度估计有 75,000 人患有 ALS。Usnoflast (ZYIL1) 是一种新型口服小分子 NLRP3 抑制剂。 Usnoflast 已在神经炎症、帕金森病、炎症性肠病 (IBD) 和多发性硬化症 (MS) 的几种临床前模型中进行了研究。美国食品药品监督管理局此前已授予 Zydus “孤儿药称号”,用于