XiaoMi-AI文件搜索系统
World File Search System最初是由美国食品药品监督管理局批准的癌症药物的总体生存益处,基于未成熟的生存数据:回顾性分析
在研究期间的发现,FDA授予223种癌症药物的营销授权,其中95个总体生存为终点。39(41%)中,这95个指示有未成熟的生存数据。 自从FDA批准以来,在营销授权后至少进行了4·3年的随访(以及中位数8·2年[IQR 5·3–12·0]),在经过39个指示的38个标签或出版物中,Pivotal试验的其他生存数据都可以使用。 关于总生存期的其他数据显示,在38个适应症中的12个(32%)中具有统计学上的显着益处,而成熟的数据在24(63%)指示下产生了统计学上不显着的总生存结果。 在标签或出版物中报告了总体生存益处的统计显着证据,中位数为1·5年(IQR 0·8-2·3),经过初步批准后。 统计上不显着的总生存结果的可用性中位时间为3·3年(2·2–2–4·5)。 临床上的总生存结果的可用性差异很大。39(41%)中,这95个指示有未成熟的生存数据。自从FDA批准以来,在营销授权后至少进行了4·3年的随访(以及中位数8·2年[IQR 5·3–12·0]),在经过39个指示的38个标签或出版物中,Pivotal试验的其他生存数据都可以使用。关于总生存期的其他数据显示,在38个适应症中的12个(32%)中具有统计学上的显着益处,而成熟的数据在24(63%)指示下产生了统计学上不显着的总生存结果。在标签或出版物中报告了总体生存益处的统计显着证据,中位数为1·5年(IQR 0·8-2·3),经过初步批准后。统计上不显着的总生存结果的可用性中位时间为3·3年(2·2–2–4·5)。临床上的总生存结果的可用性差异很大。
提交于 www.regulations.gov 2024 年 10 月 29 日 回复:食品药品管理局多元化行动计划旨在提高参与者的入学率
通过 www.regulations.gov 提交 2024 年 10 月 29 日 事由:食品药品管理局多元化行动计划,以提高临床研究中代表性不足人群参与者的招募率;行业指南草案;可用性、会议管理最佳实践;公开研讨会;征求意见,89 Fed. Reg. 54010-54012 (2024 年 6 月 28 日);卷宗编号 FDA–2021–D–0789 1 尊敬的先生或女士: 消费者保健产品协会 2(“CHPA”)很高兴向卷宗编号 FDA-2021-N-0789 提交这些关于多元化行动计划,以提高临床研究中代表性不足人群参与者的招募率;行业指南草案;可用性(指南草案)的意见。 3 该指南的既定目标是协助开展某些药物、生物制品和设备临床试验的申办方满足以指定形式提交基于 2022 年食品药品综合改革 (FDORA) 的多元化行动计划 (DAP) 的要求。CHPA 支持该机构的指令,即增加临床试验中来自历史上代表性不足的人群的参与者的招募,以提高证据的强度和普遍性,以证明 FDA 监管的医疗产品的安全性和/或有效性。4 CHPA 要求 FDA 澄清以下几点并提出建议。
美国卫生与公众服务部食品药品管理局 FDA CBER OTP 全体会议:细胞和基因治疗产品的非临床评估 2023 年 8 月 30 日
请注意,本次市政厅会议正在录制中。录音和活动材料将在未来几周内发布在 FDA 网站上。本次活动的隐藏字幕可直接在 Zoom 中获取。如果您今天有问题,请直接在 Zoom 中的问答框中输入。您可以在 Zoom 窗口底部找到该问答框。我们感谢所有提前提交的问题,我们期待在今天的活动中看到观众的问题。我们将尽最大努力在今天回答尽可能多的问题,但请注意,FDA 无法回答有关特定研究产品或药物申请 (IND) 的问题。此外,我们不会回答任何被认为超出本次活动范围的问题。最后,如果您遇到任何技术困难,请使用聊天框。太好了,我想我们已经为今天的活动做好了准备。
美国食品药品监督管理局接受优先审查Deciphera的新药申请vimseltinib用于治疗替索诺氏菌巨细胞肿瘤(TGCT)的患者
基于关键阶段3运动研究的结果,在该研究中,vimseltinib与安慰剂相比,该患者人群的统计学意义且具有临床意义的客观反应率具有统计学意义和有意义
尼日利亚联邦共和国官方公报
根据《国家食品药品监督管理局法》第 N1 章 2004 年 LFN 第 30 节和《食品、药品和相关产品(注册等)法》第 F33 章 2004 年 LFN 第 12 节授予国家食品药品监督管理局理事会(“理事会”)的权力以及所有其他授权权力,理事会在部长批准下制定以下法规 -
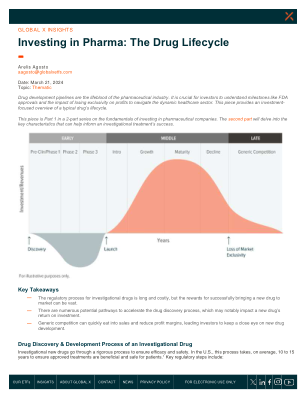
投资制药:药物生命周期
脚注 1.美国国立卫生研究院。(n.d.)。从创意到监管批准的途径:药物开发示例。访问日期:2024 年 3 月 15 日。2.食品药品管理局。(2023 年 6 月 12 日)。快速通道、突破性疗法、加速批准、优先审查。3.自然。(2023 年 8 月 7 日)。新药和股票市场:用于预测制药市场对临床试验公告反应的机器学习框架。4.食品药品管理局。(2023 年 6 月 12 日)。快速通道、突破性疗法、加速审批、优先审查。5.食品药品管理局。(2024 年 2 月 26 日)。生物仿制药产品信息。6.食品药品管理局。(2022)。仿制药审批流程。7.南加州大学。(2023 年 4 月 13 日)。减轻《通货膨胀削减法案》对处方药市场的不利影响。词汇表 药代动力学 (PK):研究人体在整个暴露过程中如何与所施用物质相互作用。药物警戒 (PV):监测人体中药物安全性的科学。
前列腺癌治疗诊断学:美国食品药品管理局同时批准首款用于选择接受配对放射性配体治疗药物的患者诊断成像药物
免责声明:本社论反映作者的观点,不应被视为代表 FDA 的观点或政策。
将美国食品药品监督管理局批准的抑制胆绿素 IXβ 还原酶 B 的药物重新定位为新型血小板减少症治疗靶点
摘要:胆绿素 IX β 还原酶 B (BLVRB) 近期被提议通过其与活性氧 (ROS) 相关的机制作为血小板减少症的新型治疗靶点。因此,我们的目标是将药物重新用于作为 BLVRB 的新型抑制剂。基于 IC 50 (<5 μ M),我们从美国食品药品监督管理局 (FDA) 批准的库中的 1496 种化合物中鉴定出 20 种化合物,并清楚地将它们的结合位点映射到活性位点。此外,我们通过核磁共振 (NMR) 和等温滴定量热法展示了详细的 BLVRB 结合模式和热力学性质 (ΔH、ΔS 和 KD),以及八种水溶性化合物的复合结构。我们期望该结果将成为进一步深入研究 BLVRB 对 ROS 积累和巨核细胞分化等相关功能的影响以及最终治疗血小板疾病的新平台。
减少粮食损失和浪费的国家战略
通过这项减少粮食损失和浪费及回收有机物的国家战略,拜登-哈里斯政府确定了具体步骤——以及环境保护署、美国农业部和食品药品管理局的补充行动——这些措施将在可能和可行的情况下加速防止粮食损失和浪费,并在整个美国供应链中回收剩余的有机废物。10 为了为所有人建立更循环的经济,环境保护署、美国农业部和美国食品药品管理局寻求强调更有效地利用原材料的机会,从废弃材料中回收宝贵的资源,使这些资源得到最高价值的利用,并帮助再生土壤。环境保护署、美国农业部和美国食品药品管理局寻求以应对气候变化的方式实现这一目标,同时包容所有社区,考虑环境正义问题和减少粮食和营养不安全的潜力,并推动创新和经济增长。环境保护署、美国农业部和美国食品药品管理局在减少粮食损失和浪费方面展开合作,三者都与各种公共和私营部门伙伴密切合作。11 这三个联邦机构有一项正式的跨部门协议,重点是合作和协调减少粮食损失和浪费的努力。 12,13
杨森 COVID-19 疫苗
杨森 COVID-19 疫苗尚未获得美国食品药品管理局 (FDA) 的批准或许可,但已获得 FDA 的紧急使用授权 (EUA),可用于对 18 岁及以上的个人进行主动免疫,以预防 2019 年冠状病毒病 (COVID-19)。该产品的紧急使用仅在声明存在根据《联邦食品药品监督管理局法案》第 564(b)(1) 条授权紧急使用该医疗产品的情况期间内获得授权,除非该声明提前终止或授权被撤销。