XiaoMi-AI文件搜索系统
World File Search SystemAcalabrutinib
Acalabrutinib 情况说明书
由于没有获得 FDA 专门批准用于治疗华氏巨球蛋白血症,因此为华氏巨球蛋白血症患者开出的阿卡替尼属于“非说明书用药”,即该药物用于未经批准的适应症或未批准的年龄组、剂量或给药途径。这种开出超出官方批准适应症用途的药物的能力在医学界很常见,包括用于治疗华氏巨球蛋白血症的大多数其他药物,但伊布替尼和伊布替尼/利妥昔单抗组合除外。一项大型单组(单一药物)、多中心 2 期试验由 19 家欧洲学术机构和 8 家美国学术机构参与,该试验提供的证据表明,对于之前未接受过治疗或患有复发/难治性华氏巨球蛋白血症的患者,阿卡替尼作为单一疗法有效且安全性可控。需要进一步研究以确定其相对于标准治疗的疗效,并研究联合疗法是否能改善疗效。
ArrayRx(UMP 计划)| 预授权标准 | 第 1 部分
I. 阿卡替尼 (Calquence) 在儿科人群中的安全性和有效性尚未确定。II. CLL 和 SLL 是难治性、危及生命的疾病,因此使用阿卡替尼 (Calquence) 治疗需要咨询肿瘤科医生或血液科医生。III. 目前尚无阿卡替尼 (Calquence) 与其他 BTK 抑制剂 [zanubrutinib (Brukinsa)、ibrutinib (Imbruvica)] 的头对头研究的已发表数据,以显示某种 BTK 抑制剂优于另一种 BTK 抑制剂。目前也没有关于在确诊为 MCL 或 CLL/SLL 且对其他 BTK 抑制剂复发或有耐药性的患者中使用 BTK 抑制剂的已发表数据。此外,没有数据显示一种 BTK 抑制剂可以克服 BTK 抑制剂的常见耐药机制。IV.两项随机对照试验证明了阿卡替尼 (Calquence) 对 CLL 患者的疗效,因为这是同一种疾病,因此试验对象包括 SLL 患者。ELEVATE-TN 试验是一项随机、多中心、开放标签、主动对照、三组试验,研究了阿卡替尼 (Calquence) 与奥比妥珠单抗的联合治疗,阿卡替尼 (Calquence)
慢性淋巴细胞白血病的靶向治疗
摘要:在慢性淋巴细胞白血病 (CLL) 中,对疾病生物学的深入了解导致过去十年来开发和临床使用不同的靶向药物,包括布鲁顿酪氨酸激酶 (BTK) 抑制剂。第一个获准用于临床的 BTK 抑制剂是伊布替尼,它表现出优异的疗效和良好的耐受性。最近,人们对新型更具选择性的 BTK 抑制剂的兴趣日益浓厚,这种抑制剂可以减少药物的脱靶效应,从而最大限度地减少副作用和随后的治疗中断或停止。阿卡替尼是一种口服不可逆的 BTK 抑制剂,其特点是对其他激酶没有抑制作用。在这篇综述中,我们介绍了阿卡替尼和基于阿卡替尼的联合治疗对复发/难治性和初治 CLL 患者的临床疗效的临床试验最新数据。我们描述了该药物的安全性,描述了感兴趣的副作用,并讨论了接受阿卡替尼治疗的患者的临床管理。由于其疗效和良好的安全性,阿卡替尼已成为当前多种获批的 CLL 治疗方案中的一种可行治疗选择。关键词:慢性淋巴细胞白血病、阿卡替尼、布鲁顿酪氨酸激酶抑制剂
IDH1-Spezifischer抑制剂BEI AML
- 壁炉细胞淋巴细胞PHOM(MCL)的处理,具体取决于病人,患者的适应性和年龄。迄今为止,年龄较大和未受影响的患者已接受Bendamustin Plus Ritu Ximab(BR)的组合。在双盲阶段III研究回声中,Bruton Tyrosinkina sein抑制剂(BTKI)Acalabrutinib(CalQuence®)在598例MCL≥65岁的患者中作为BR的合并伴侣测试[Wang M等。右侧。2024; 8(补充1):Abstr LB3439]。“第二代BTKI目前已被批准用于慢性淋巴白血病的行为,并且在研究中比Ibrutinib GE表现出更大的选择性。”所有研究参与者都接受了六个周期BR,然后进行了两年的利妥昔单抗维持疗法,Rando不喜欢Acalabrutinib或安慰剂至
如何支持增加的复杂性
-Acalabrutinib -Axibabtagene ciloleucel ** - copanlisib -duvelisib -ibrutinib * -Mogamulizumab -nivolumab -nivolumab * -obinutuzumab * -pembrolizumab -pembrolizumab * -polatuzumab vedotin -piotin -piiq -tisageNleceNleceNleceNleceNleceLeceLibrut -Zan -liceceliucel ** - tafasitamab -cxix -tazemetostat -Brexucabene autoleucel ** - selinexor
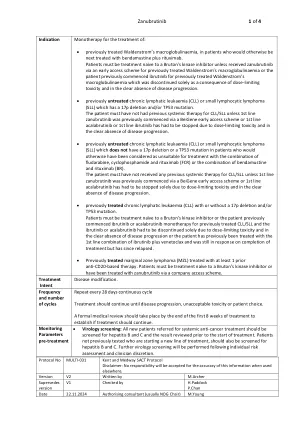
Zanubrutinib 1 / 4
• 之前接受过治疗的华氏巨球蛋白血症患者,如果接受治疗,下一步将接受苯达莫司汀联合利妥昔单抗治疗。患者必须未接受过布鲁顿激酶抑制剂治疗,除非患者通过早期使用计划接受了赞布替尼治疗之前接受过治疗的华氏巨球蛋白血症,或之前开始使用伊布替尼治疗之前接受过治疗的华氏巨球蛋白血症,但停药仅是因为剂量限制性毒性,且疾病明显没有进展。• 之前未接受过治疗的慢性淋巴白血病 (CLL) 或小淋巴细胞淋巴瘤 (SLL),存在 17p 缺失和/或 TP53 突变。患者先前必须未接受过 CLL/SLL 的全身治疗,除非先前通过百济神州早期使用计划开始使用一线 zanubrutinib,或者由于剂量限制性毒性并且明显没有病情进展而必须停止使用一线 acalabrutinib 或一线 ibrutinib。• 先前未接受过治疗的慢性淋巴细胞白血病 (CLL) 或小淋巴细胞淋巴瘤 (SLL),没有 17p 缺失或 TP53 突变,这些患者原本被认为不适合使用氟达拉滨、环磷酰胺和利妥昔单抗 (FCR) 联合治疗或苯达莫司汀和利妥昔单抗 (BR) 联合治疗。患者既往未接受过任何针对 CLL/SLL 的全身治疗,除非之前通过 BeiGene 早期使用计划开始使用一线 zanubrutinib,或一线 acalabrutinib 仅因剂量限制性毒性且在明显无疾病进展的情况下必须停用。• 先前接受过治疗的慢性淋巴细胞白血病 (CLL),无论是否存在 17p 缺失和/或 TP53 突变。患者必须是未接受过布鲁顿激酶抑制剂治疗的患者,或患者之前已开始使用伊布替尼或阿卡替尼单药治疗先前接受过治疗的 CLL/SLL,并且仅因剂量限制性毒性且在明显无疾病进展的情况下必须停用伊布替尼或阿卡替尼,或患者之前曾接受过伊布替尼加维奈克拉的一线组合治疗,并且在完成治疗时仍有反应,但此后复发。 • 曾接受过至少 1 种抗 CD20 疗法治疗的边缘区淋巴瘤 (MZL)。患者必须未接受过布鲁顿激酶抑制剂治疗,或已通过公司准入计划接受过 zanubrutinib 治疗。治疗意向
使用Covalfinder评估共价BTK抑制剂
目前,有6种批准的BTK抑制剂(Ibrutinib,acalabrutinib,Zanubrutinib,tirabrutinib和orelabrutinib)靶向BTK的激酶结构域,形成与Cys481的共价键。remibrutib是另一种不可逆的抑制剂,由于与非磷酸化形式的BTK结合而表现出良好的激酶选择性,并且正在荨麻疹和哮喘的诊所进行评估。最近,具有与Cys481建立可逆共价键并暂时失活BTK(Rilzabrutinib)的杂化抑制剂已进入3阶段临床试验,以治疗Pemphigus和免疫血栓性血栓性血小板purpura 1,2。
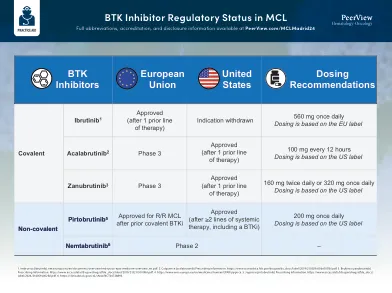
BTK抑制剂调节状态MCL
1。imbruvica(ibrutinib)。ema.europa.eu/en/documents/overview/imbruvica-epar-medicine-medicine-overview_en.pdf。2。calquence(acalabrutinib)处方信息。https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/210259S006S007LBL.pdf。 3。 brukinsa(zanubrutinib)处方信息。 https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/213217S000LBL.pdf。 4。https://www.ema.europa.eu/en/medicines/human/epar/jaypirca。 5。 Jaypirca(Pirtobrutinib)处方信息。 https://www.accessdata.fda.gov/drugsatfda_docs/ label/2024/216059S002LBL.pdf。 6。https://clinicaltrials.gov/ct2/show/nct04728893。https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/210259S006S007LBL.pdf。3。brukinsa(zanubrutinib)处方信息。https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/213217S000LBL.pdf。 4。https://www.ema.europa.eu/en/medicines/human/epar/jaypirca。 5。 Jaypirca(Pirtobrutinib)处方信息。 https://www.accessdata.fda.gov/drugsatfda_docs/ label/2024/216059S002LBL.pdf。 6。https://clinicaltrials.gov/ct2/show/nct04728893。https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/213217S000LBL.pdf。4。https://www.ema.europa.eu/en/medicines/human/epar/jaypirca。5。Jaypirca(Pirtobrutinib)处方信息。https://www.accessdata.fda.gov/drugsatfda_docs/ label/2024/216059S002LBL.pdf。6。https://clinicaltrials.gov/ct2/show/nct04728893。
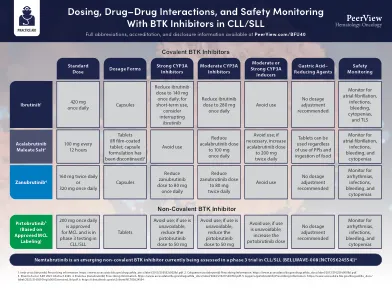
剂量,药物 - 药物相互作用和安全监控...
1。imbruvica(ibrutinib)处方信息。https://www.accessdata.fda.gov/drugsatfda_docs/label/2015/2015/205552S002LBL.pdf。2。calquence(acalabrutinib)处方信息。https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/210259S000LBL.pdf。 3。 Sharma S等。 Ash 2021。 摘要4365。 4。 brukinsa(zanubrutinib)处方信息。 https://www.accessdata.fda.gov/drugsatfda_docs/label/2023/213217S007LBL.pdf。 5。 Jaypirca(Pirtobrutinib)处方信息。 https://www.accessdata.fda.gov/drugsatfda_docs/ label/2023/216059orig1s000corrceed_lbl.pdf。 6。https://clinicaltrials.gov/ct2/show/nct05624554。https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/210259S000LBL.pdf。3。Sharma S等。Ash 2021。摘要4365。4。brukinsa(zanubrutinib)处方信息。https://www.accessdata.fda.gov/drugsatfda_docs/label/2023/213217S007LBL.pdf。 5。 Jaypirca(Pirtobrutinib)处方信息。 https://www.accessdata.fda.gov/drugsatfda_docs/ label/2023/216059orig1s000corrceed_lbl.pdf。 6。https://clinicaltrials.gov/ct2/show/nct05624554。https://www.accessdata.fda.gov/drugsatfda_docs/label/2023/213217S007LBL.pdf。5。Jaypirca(Pirtobrutinib)处方信息。https://www.accessdata.fda.gov/drugsatfda_docs/ label/2023/216059orig1s000corrceed_lbl.pdf。6。https://clinicaltrials.gov/ct2/show/nct05624554。
靶向癌症治疗
Lymphoma: Ibritumomab tiuxetan (Zevalin) , denileukin diftitox (Ontak) , brentuximab vedotin (Adcetris) , rituximab (Rituxan) , vorinostat (Zolinza) , romidepsin (Istodax) , bexarotene (Tartene) , borzotremi (Velcatremia) (Velcatremia) tyn) , ibrutinib (Imbruvica) , siltuximab (Sylvant) , idelalisib (Zydelig) , belinostat (Beleodaq) , obinutuzumab (Gazyva) , nivolumab (Opdivo) , pembrolizumab (Keytruda) , rituximab and hyaluronidase (Rhuman hydroxide) Aliqopa) , axicabtagene ciloleucel (Yescarta) , acalabrutinib (Calquence) , tisagenlecleucel (Kymriah) , venetoclax (Venclexta) , mogamulizumab-kpkc (Poteligeo) , duvelisib (Copiktra) , poltuzutinib-poladopinib (Bruxiq, Zanquiq) insa) , tazemetostat hydrobromide (Tazverik) , selinexor (Xpovio) , tafasitamab-cxix (Monjuvi) , brexucabtagene autoleucel (Tecartus) , crizotinib (Xalkori) , umbralisib tosylate (Ukoniq) , mara lisocab (Bleugene)