XiaoMi-AI文件搜索系统
World File Search Systemadenocarcinoma
表观遗传改变作为生物标志物和胰腺导管腺癌治疗的新目标的新兴作用
胰腺导管腺癌(PDAC)仍然是高死亡率的癌症[1]。这在很大程度上是由于晚期诊断阻碍了手术疗法,因为大多数患者患有局部晚期或转移性疾病。在侵略性肿瘤生物学中发现了不良结局的重要驱动因素,尽管使用了现代的细胞毒性药物方案(例如Folfirinox),但对许多常规药物的反应率却很少。尽管在理解潜在的疾病机制方面取得了进展,但几个问题仍未得到解决[2]。驱动该疾病的主要遗传突变,例如KRAS的激活或抑制肿瘤抑制剂TP53和CDKN2A的失活,都被证明很难通过靶向疗法进行修改,从而限制了当前的医疗方案[3,4]。因此,对替代治疗目标的需求仍然很强。表观遗传改变已与癌症有关数十年。越来越多地表观遗传机制被视为恶性表型的关键驱动因素[5,6]
从恶性进展到治疗靶向:间皮素在胰腺导管腺癌中的当前见解
摘要:胰腺导管腺癌 (PDAC) 占所有胰腺肿瘤的 90%,是一种极具破坏性的疾病,预后不良且发病率不断上升。缺乏可用的特定诊断测试和有限的治疗机会加剧了这一问题。在过去的 10 年里,人们越来越关注间皮素 (MSLN) 作为一种有前途的 PDAC 相关抗原。MSLN 在正常组织 (腹膜、胸膜和心包) 中的表达有限,在 80% 到 90% 的 PDAC 中过度表达,使其成为治疗 PDAC 患者的理想候选药物。此外,它在恶性进展中的作用与其参与肿瘤细胞增殖和化疗耐药性有关,凸显了其靶向性的重要性。因此,一些临床试验正在研究 PDAC 中的抗 MSLN 有效性。在这篇综述中,我们概述了 MSLN 在 PDAC 进展过程中所起的不同作用。最后,我们还总结了目前正在临床上测试的不同 MSLN 靶向治疗方法。
操纵调节性T细胞:是解锁有效免疫疗法的胰腺导管腺癌的关键吗?
在过去的半个世纪中,胰腺导管腺癌(PDAC)的五年生存率几乎没有提高。它固有地抵抗了FDA-批准的免疫疗法,这改变了其他晚期实体瘤患者的前景。积累的证据将这种抵抗力与其标志性免疫抑制环境有关,后者灌输了在肿瘤 - 纤维化效应效应T细胞中进行性功能障碍。该环境是在免疫抑制细胞种群(包括调节性T细胞(T Reg))的肿瘤开始时建立的,这些细胞(T Regs)与恶性PDAC的进展并行积累。因此,T Regs的治疗操作已引起了显着的科学和商业关注,这是由于发现丰富的肿瘤 - 填充t regs与PDAC患者的预后较差相关的发现所增强。在此,我们提出了一种机制,以抗PDAC对抗PD-1和CTLA-4免疫疗法的抗性,并重新评估追求T型剂量靶向疗法的理由,以鉴于最近的研究,这些研究促进了患者来源的肿瘤样品的免疫景观。我们评估正在逐步限制对PDAC治疗的免疫抑制的策略,以及提供初步证据的临床活动证据的SIGNPOST早期试验。在这种情况下,我们发现了对PDAC持续开发T Reg的免疫疗法的投资的令人信服的论点。
APC中的免疫景观和TP53与结肠腺癌中相关的肿瘤微环境:生物信息学分析
简介:APC和TP53是结肠腺癌(COAD)中最常规突变的两个基因,尤其是在进行性恶性肿瘤和抗肿瘤免疫反应中。当前的生物信息学分析研究结肠腺癌中的APC和TP53基因表达谱是生存的预后特征,尤其是集中在相关的免疫微环境上。方法:分别从癌症癌和正常组织样品的临床和遗传数据中获得了癌症基因组图集(TCGA)-COAD和基因型 - 组织表达(GTEX)在线数据库。通过单向方差分析测试在两组中分析了遗传差异表达。kaplan - 使用Meier存活曲线来估计总生存率(OS)。p <0.05在统计学上是显着的。通过Spearman的相关分析评估了免疫细胞募集与APC和TP53状态之间的链接数据库的基因表达互动分析数据库。结果:在66.74%和85.71%的454和755.71%的APC和TP53中,分别在结肠和直肠连接原位位点中的454例和7例TCGA-COAD患者,与GTEX组相比,较高的log2转录组每百万读物(318个样本中)和368样品中的318个样本)。生存曲线显示,高APC和TP53轮廓结肠的OS较差。结论:APC和TP53基因突变在结肠癌中占上风,并且与预后不良和最短生存期非常相关。Spearman对免疫细胞的分析表明,APC状态与T细胞CD4Þ,T细胞CD8Þ,NK细胞和巨噬细胞的结构之间存在很强的正相关性,并且状态与T细胞CD4Þ,T细胞CD8的状态与施用之间的正相关。浸润的T细胞CD4Þ,T细胞CD8,NK细胞和巨噬细胞填充结肠微环境,并调节肿瘤进步,免疫逃避和对标准化学疗法的敏感性的机制。需要更全面的研究来证明这些结果并将其变成新的治疗前景。
血清神经元特异性烯醇酶与肺腺癌中基因突变的检测之间的相关分析
在现有疗法中,靶向疗法是失去手术机会的患者有害和最容忍的治疗方法(4)。当前,用于遗传检测的样品主要是从患者的血液,胸腔积液,尿液或肿瘤组织中收集的,其中肿瘤组织在遗传检测中具有最高的特异性和敏感性(5-7)。但是,侵入性程序不适用于转移性疾病或健康状况受损的患者(6)。由于耐药性,患者必须进行多种基因检测。此外,组织样品并不总是可用的,因此靶向药物的选择通常取决于血液样本检测(8)。为了降低耐药性,已经提出了替代使用两个靶向药物的使用,但到目前为止,效果尚不清楚(9)。因此,早期并有效地识别患有基因突变的患者以改善患者生存并减轻患者的财务负担至关重要。
脑转移筛查策略与第四阶段肺腺癌中的神经系统症状有关
。cc-by-nc-nd 4.0国际许可证是根据作者/资助者提供的,他已授予Medrxiv的许可证,以永久显示预印本。(未通过同行评审认证)
组蛋白乙酰化相关基因标记对胃腺癌预后和免疫治疗效果的预测及体外验证
建立了由8个组蛋白乙酰化相关基因组成的STAD预后模型,根据中位风险评分将STAD患者分为高危组和低危组,高危组的预后较低危组差。两组在体细胞突变、免疫亚型、临床病理特征、肿瘤微环境、免疫细胞浸润和免疫活性、免疫治疗预测和药物敏感性等方面存在明显差异。基因本体论(GO)和京都基因与基因组百科全书(KEGG)分析结果表明,两组中的差异表达基因(DEG)参与了与癌症相关的过程和途径。细胞分析表明,DCLK1是胃癌的促癌因子,可促进胃癌细胞对奥沙利铂产生耐药性。
对分选的食管腺癌细胞进行靶向测序揭示了分离亚群中的已知和新突变
结果 38 个 EAC 中有 35 个携带至少一种基质细胞中不存在的体细胞突变;73.7%、10.5% 和 10.5% 分别携带肿瘤蛋白 53、细胞周期蛋白依赖性激酶抑制剂 2A 和 SMAD 家族成员 4 的突变。此外,在 38 例病例中的 2 例中发现了肝细胞核因子-1α 的 2 个新突变。肿瘤蛋白 53 基因异常比 p53 IHC 更具信息量。相反,SMAD4 的缺失在 IHC 中更常见(53%)并且与更高的复发率相关(P=0.015)。仅通过细胞分选,我们才能检测到 7 个 EAC 中存在超二倍体和伪二倍体亚克隆,它们表现出不同的突变负荷和/或额外的拷贝数扩增,表明这些癌症具有高度的遗传异质性。
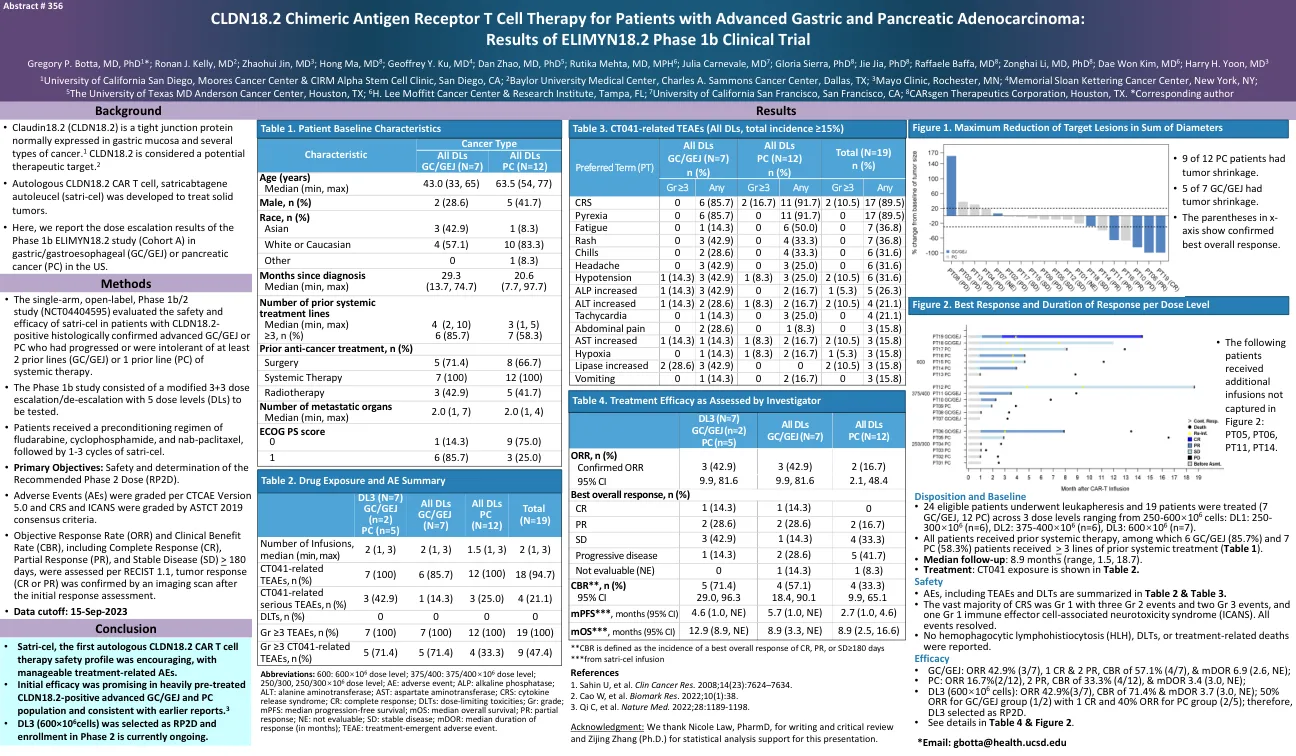
CLDN18.2晚期胃和胰腺腺癌患者的嵌合抗原受体T细胞治疗:
Gr ≥3 Any Gr ≥3 Any Gr ≥3 Any CRS 0 6 (85.7) 2 (16.7) 11 (91.7) 2 (10.5) 17 (89.5) Pyrexia 0 6 (85.7) 0 11 (91.7) 0 17 (89.5) Fatigue 0 1 (14.3) 0 6 (50.0) 0 7 (36.8) Rash 0 3 (42.9) 0 4 (33.3) 0 7(36.8)发冷0 2(28.6)0 4(33.3)0 6(31.6)头痛0 3(42.9)0 3(25.0)0 6(31.6)低血压1(14.3)3(14.3)3(42.9)1(8.3)1(8.3)1(8.3)3(25.5)3(25.5)2(25.5)2(10.5)6(31.6)6(31.6)Alp Alp Alp Alp Alp Alp Alp Alp Alp升高(26.3)Alt增加了1(14.3)2(28.6)1(8.3)2(16.7)2(16.7)2(10.5)4(21.1)心动过速0 1(14.3)0 3(25.0)0 4(25.0)0 4(21.1)腹痛0 2(28.6)0 1(28.6)0 1(8.3)0 1(8.3)0 3(8.3)0 3(15.8)AST 1(8.3)AST 1(8.3)1(8.3)1(14.3)1(14.3)1(14.3) 2(10.5)3(15.8)缺氧0 1(14.3)1(8.3)2(16.7)1(5.3)1(5.3)3(15.8)脂肪酶增加2(28.6)3(42.9)3(42.9)0 0 2(10.5)3(15.8)3(15.8)
新型光谱计算机断层扫描中的定量参数:胃腺癌患者KI-67表达的评估
结果分别分别为37例和71例患者,分别为低和高的KI-67表达。ct 40 KeV-VP,CT 70 KeV-VP,CT 100 KEV-VP和Z EFF相关参数明显更高,但是与具有高KI-67表达式状态的基团表达状态较低的组中,与IC相关的参数较低,而其他分析的参数则没有显示两组之间的统计差异。Spearman的相关性分析表明,CT 40 KEV-VP,CT 70 KEV-VP,CT 100 KEV-VP,Z EFF,Z EFF和N Z EFF与KI-67状态呈负相关,而IC和NIC与KI-67状态呈正相关。ROC分析表明,光谱参数的多变量模型在识别KI-67状态[曲线下的面积(AUC)= 0.967;灵敏度为95.77%;特异性91.89%)]。然而,单变量模型的区分功能是中等的(AUC值0.630-0.835)。此外,NZ Eff