XiaoMi-AI文件搜索系统
World File Search Systemaminotransferase
2 型糖尿病和肥胖症中 MASLD 的诊断和非侵入性评估
缩写:AST,天冬氨酸转氨酶;AUROC,受试者工作特征曲线下面积;BMI,身体质量指数;CK-18,细胞角蛋白-18;FAST,Fibroscan-AST;FIB-4,纤维化-4指数;GBM,梯度增强机;HOMA,稳态模型评估;MASH,代谢功能障碍相关脂肪性肝炎;MAST,MRI-AST;MEFIB,MRE 联合 FIB-4;MRE,磁共振弹性成像;MRI,磁共振成像;NASH,非酒精性脂肪性肝炎;VCTE,振动控制瞬时弹性成像。
发展代谢综合征
由于生活方式的变化和衰老,代谢综合征(MetS)的患病率及其成本正在增加。这项研究旨在开发一个深层神经网络模型,以根据营养摄入和其他与Mets相关的因素对MetS进行预测和分类。这项研究包括韩国国家健康和营养检查调查(2013- 2018年)40-69岁的17,848个人。,我们将MetS(存在3-5个风险因素)设置为因变量,而52个与MetS相关的因素和营养摄入变量为回归分析中的自变量。分析通过常规逻辑回归,基于机器学习的逻辑回归和深度学习进行了比较和分析模型的准确性,精度和回忆。火车数据的准确性为81.2089,在本研究中开发的MetS分类和预测模型中,测试数据的准确性为81.1485。这些精度高于传统的逻辑回归或基于机器学习的逻辑回归获得的精度。精度,回忆和F1得分也显示了深度学习模型的高精度。血液丙氨酸氨基转移酶(β= 12.2035)水平显示出最高的回归系数,其次是血天然天冬氨酸氨基转移酶(β= 11.771)水平,腰围(β= 10.8555),体重指数,体重指数,体重指数(β= 10.3842),和血甘糖级= 10.1.1800.1800.180。脂肪(胆固醇[β= -2.0545]和饱和脂肪酸[β= -2.0483])在营养摄入量中显示出较高的回归系数。与传统的逻辑回归或基于机器学习的逻辑回归相比,用于分类和预测的深度学习模型的准确性更高。
抗癌剂“tasfygo®片35mg”
抗癌剂“TASFYGO®片35mg”(tasurgratinib琥珀酸酯)在日本批准在带有FGFR2基因融合或重新安排Eisai Co.,Ltd.有限公司(总部:Tokyo:Tokyo,CEO:Haruo Naito and Isalrory for Advorruation and eisai and over for for for Figran)的胆道癌或重新排列的胆道癌。日本的受体(FGFR)选择性酪氨酸激酶抑制剂“TASFYGO®TASFYGO®片剂35mg”(Tasurgratinib琥珀酸酯)(tasurgratinib琥珀酸酯)用于治疗患有FGFR2基因融合或重排的不可切除的胆道癌患者,这些患者在癌症化学治疗后进展。在日本,它已收到卫生,劳动和福利部(MHLW)的孤儿药物,并于2023年12月提交了营销授权申请。此批准基于数据,例如由Eisai在日本和中国进行的多中心,开放标签,单臂临床II期试验(研究201)的结果。研究201招募了63例患有不可切除的晚期或转移性胆管癌患者,该患者具有FGFR2基因融合或以前用基于吉西他滨的组合化疗治疗的重排。这项研究的主要终点是客观响应率(ORR),次要终点包括安全性。1这项研究达到了其主要终点,并超过了具有统计学意义的预先指定的肿瘤反应阈值(15%):用独立成像综述评估,用TasFygo治疗的患者的ORR为30.2%(90%置信区间(CI):20.7-41.0)。治疗 - 急性不良事件(发生率为25%或以上)是高磷酸血症(81.0%),棕榈 - 翼展红细胞炎综合征(44.4%),腹泻(44.4%),腹泻(36.5%)(36.5%),天冬氨酸氨基糖化酶增加(31.7%),Alanity Amin(28.7%)(28.7%)(28.7%)(28.7%)(28.7%)(31.7%)(28.7%) (25.4%)。
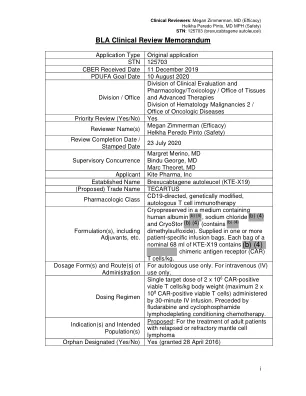
临床审查备忘录,2020 年 7 月 23 日 - TECARTUS
AE 不良事件 AESI 特别关注的不良事件 Allo 同种异体 ALT 丙氨酸氨基转移酶 AR 不良反应 AST 天冬氨酸氨基转移酶 Auto 自体 BLA 生物制品许可申请 BOR 最佳客观反应 CAR 嵌合抗原受体 CBER 生物制品评估与研究中心 CMC 化学、制造和控制 CI 置信区间 CNS 中枢神经系统 CR 完全缓解 CRS 细胞因子释放综合征 CSF 脑脊液 CSR 临床研究报告 CT 计算机断层扫描 CTCAE 不良事件常用术语标准 dL 分升 DLT 剂量限制性毒性 DOR 反应持续时间 eCTD 电子通用技术文档 ECOG 东部肿瘤协作组 EEG 脑电图 EQ-5D 欧洲生活质量 5 维度 ETASU 确保安全使用的要素 FAS 全分析集 FDA 美国食品药品监督管理局 GCP 药物临床试验管理规范 HBV 乙型肝炎病毒 HCV 丙型肝炎病毒 HIV 人类免疫缺陷病毒 HLH噬血细胞性淋巴组织细胞增生症 HSCT 造血干细胞移植 IAS 推理分析集 IND 研究性新药申请 IP 研究产品 IPI 国际预后指数 ISS 安全性综合摘要 IQR 四分位距 IRC 独立审查委员会 IR 信息请求 IV 静脉注射;静脉内 IWG 国际工作组 LTFU 长期随访 MAS 巨噬细胞活化综合征
polyphenols-as As调制剂,成立的gut- ...
缩写:Alt,丙氨酸氨基转移酶;猿,苹果多酚提取物; apoe /,载脂蛋白E; AST,天冬氨酸氨基转移酶; BMI,体重指数; BW,体重; CD,克罗恩病; CRC,结直肠癌; CRP,C反应蛋白; CTR,控制; DGGE,变性梯度凝胶电泳; DP,聚合程度; DSS,硫酸葡萄糖钠; EGCG,epigallocatechin Gallate; EGCG3-ME,Epigallocatechin 3- O-(3- O-甲基)透足; f,分数; f/b,企业/杀菌剂; GMCSF,粒细胞巨噬细胞群刺激因子; GRO,生长调节的癌基因; GSPE,葡萄种子原腺苷提取物; GTE,绿茶提取物; HBA1C,血红蛋白A1C; HFD,高脂饮食; HFHSD,高脂高蔗糖折叠; HTS,高通量测序; IBD,炎症性肠病;国际益生菌和益生元科学协会Isapp; LDLR /,LDL受体缺陷; LFD,低脂饮食; LPS,脂多糖; MCD,蛋氨酸 - 胆碱缺乏;大都会,代谢综合征; NAFLD,非酒精性脂肪肝病;纳什,非酒精性脂肪性肝炎; PACS,低聚蛋白酶蛋白; PCR-DGGE,聚合酶链反应构成梯度凝胶电泳; PFE,pyracantha fortuneana果实提取物; PPEP,果皮桃萃取的多酚; SASP,磺胺丙嗪; SCFA,短链脂肪酸; TLR4,像受体4一样收费; TMAO,三甲胺-N-氧化物; TNB,2,4,6-三硝基苯磺酸; TPC,总多酚的含量; UC,溃疡性结肠炎; w/v,重量/体积。
非洲乙肝出生剂量疫苗接种介绍:
ALT 丙氨酸氨基转移酶 抗乙肝核心抗原的抗 HBc 抗体 抗乙肝 e 抗原的抗 HBe 抗体 抗乙肝表面抗原的抗 HBs 抗体 AST 天冬氨酸氨基转移酶 CGHE 全球消除肝炎联盟 CPAD 紧凑型预填充自毁装置 DALY 伤残调整生命年 DNA 脱氧核糖核酸 DTP 白喉、破伤风、百日咳 GDP 国内生产总值 GHSS 全球卫生部门战略 HBeAg 乙肝 e 抗原 HBIG 乙肝免疫球蛋白 HBsAg 乙肝表面抗原 HBV 乙肝病毒 HBV DNA 乙肝病毒脱氧核糖核酸 HCC 肝细胞癌 HepB 乙肝疫苗 HepB3 三剂乙肝婴儿疫苗 HepB-BD 乙肝出生剂量 HIV 人类免疫缺陷病毒 ICER 增量成本效益比 IgG免疫球蛋白 G IgM 免疫球蛋白 M mIU/ml 毫国际单位每毫升 MTCT 母婴传播 NITAG 国家免疫技术咨询组 rDNA 重组脱氧核糖核酸 TFGH 全球卫生工作组 U/L 单位每升 ULN 正常上限 UN 联合国 US CDC 美国疾病控制与预防中心 WHO 世界卫生组织 WHO AFRO 世界卫生组织非洲区域办事处
761174Orig1s000 - accessdata.fda.gov
3R 减少/改进/替换 AC 咨询委员会 ADA 抗药抗体 ADCC 抗体依赖性细胞介导的细胞毒性 ADME 吸收、分布、代谢和排泄 ADR 药物不良反应 AE 不良事件 AESI 特别关注的不良事件 ALC 绝对淋巴细胞计数 ALP 碱性磷酸酶 ALT 丙氨酸氨基转移酶 ANC 绝对中性粒细胞计数 aPTT 活化部分凝血活酶时间 ASCO 美国临床肿瘤学会 AST 天冬氨酸氨基转移酶 ATC 解剖治疗化学 BICR 盲法独立中央审查 BLA 生物制品许可申请 BMI 身体质量指数 BOR 最佳总体反应 BPCA 最佳儿童药品法案 BRF 效益风险框架 BTD 突破性疗法认定 CBER 生物制品评估与研究中心 C avg 平均浓度 CBC 全血细胞计数 CDC 补体依赖性细胞毒性 CDER 药物评估与研究中心 CDRH 设备和放射健康中心 CDTL 跨学科团队负责人 CFR 联邦法规 CI 置信区间 CL清除率 CL ss 稳态清除率 C max 最大浓度 CMC 化学、制造和控制 C min 最低浓度 CNS 中枢神经系统 COA 临床结果评估 COSTART 不良反应术语词典编码符号 CR 完全缓解
lumakras®(Sotorasib)样本上诉信患者姓名
重要的安全信息肝毒性•Lumakras可能引起肝毒性并增加ALT或AST,这可能导致药物诱导的肝损伤和肝炎。•在接受单位药物Lumakras 960 mg肝毒性的NSCLC患者的汇总安全群体中发生在27%的患者中,其中16%为≥3级。在需要剂量修饰的肝毒性患者中,需要用皮质类固醇治疗64%。•在接受单位药物Lumakras 960 mg的NSCLC患者的合并安全群体中,接受Lumakras的患者中有17%增加了丙氨酸氨基转移酶(ALT)/增加天冬氨酸氨基转移酶(AST);其中9%是≥3级。首先发作Alt/AST的中位时间为6.3周(范围:0.4至42)。增加了ALT/AST,导致剂量中断或减少的患者发生在9%的接受Lumakras治疗的患者中。lumakras由于2.7%的患者的ALT/AST增加而永久停止。药物诱导的肝损伤发生在1.6%(所有等级),包括1.3%(≥3级)。•在接受单位药物Lumakras 960 mg的NSCLC患者的汇总安全群体中,在开始前,总共有40%的最近(≤3个月)的免疫疗法患者患有肝毒性。在最后剂量的免疫疗法后3个月以上,在从未接受过免疫疗法的17%的患者中观察到了18%的肝毒性事件。不管先前的免疫疗法的时间如何,有94%的肝毒性事件改善或通过lumakras的剂量修饰,有或不接受皮质类固醇治疗而改善或解决。
线粒体减少氨基氧霉素的成分1 p。 ...
缩写:165t,位于165位的苏氨酸(突变体); A165,位于165位的丙氨酸(野生型); AAV,腺相关病毒; ACTB,β-肌动蛋白; Alt,丙氨酸氨基转移酶; AST,天冬氨酸氨基转移酶; ATF6,激活转录因子6; CHX,环己酰亚胺; CQ,氯喹; DBEQ,Dibenzylquinazoline-2,4-二胺; ECL,增强的化学发光; ERAD,内质网相关降解; FACL4,脂肪酸-COA连接酶4; GCKR,葡萄糖酶调节剂; GWAS,全基因组协会研究; HMARC1,人线粒体减少的组件1; IP,免疫沉淀; IRE1,内切核酸酶肌醇提高酶1; ITR,反向终端重复;妈妈,线粒体相关的膜; MARC1,线粒体减少氨基氧霉素的成分1; MASLD,代谢功能障碍相关的脂肪分裂肝病; Mboat7,包含7的膜结合的O-酰基转移酶结构域; MMARC1,小鼠线粒体减少的成分1; ORO,油红色O染色; PERK,蛋白激酶R样性内质网(ER)激酶; PNPLA3,含patatin样磷脂酶结构域的蛋白3; RTA,相对总丰度; Ru,相对单位; SD,标准偏差; SDS,十二烷基硫酸钠; SDS-PAGE,十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳; SEM,平均值的标准误差; TM6SF2,跨膜6超家族成员2; UBC,泛素C; UBE2E1,泛素结合酶E2-E1; UBE3EC,泛素蛋白连接酶E3C; UPR,展开的蛋白质反应; UPS,泛素介导的蛋白酶体(降解)系统; VCP,含勇气的蛋白质。
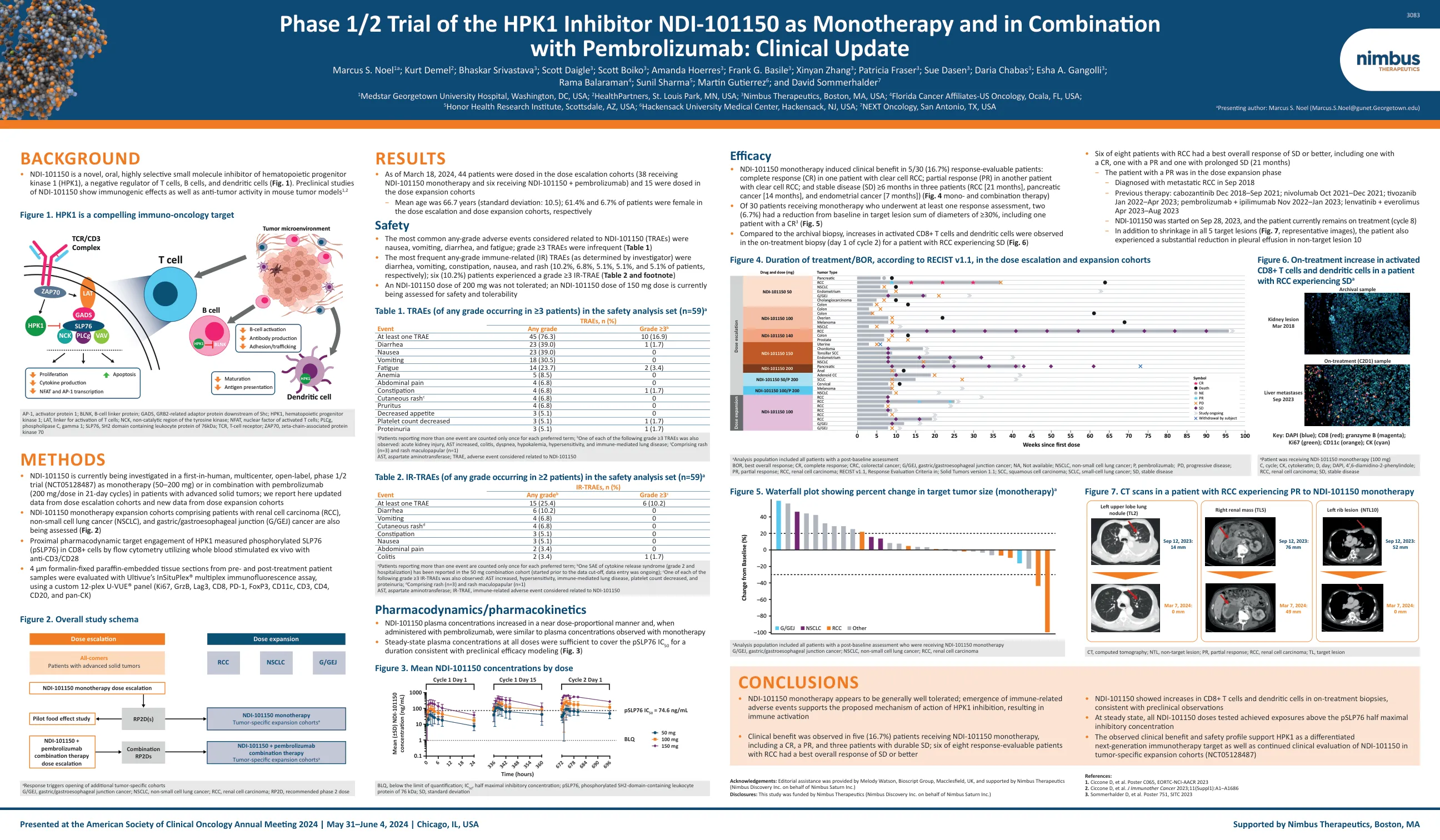
HPK1抑制剂NDI-101150的1/2期试验作为单一疗法和组合 SITC-2023-HPK1-Clinical-Poster.pdf
每一个首选期限仅计算一次报告多个事件的患者; b在50毫克组合队列中报道了一个细胞因子释放综合征(2级和住院)(在数据截止之前开始,正在进行数据输入); C还观察到以下每种≥3级IR-Traes之一:AST增加,超敏反应,免疫介导的肺部疾病,血小板计数降低和蛋白尿; d包含皮疹(n = 3)和皮疹大斑(n = 1),天冬氨酸氨基转移酶; IR-Trae,与NDI-101150有关的免疫相关的不良事件