XiaoMi-AI文件搜索系统
World File Search System带状疱疹疫苗接种可降低阿尔茨海默氏症的风险和...
神经炎症与AD中的细胞因子和生长因子有关。细胞因子和神经营养蛋白对PD和Lewy身体痴呆(LBD)也有重大影响。生长因子,神经营养蛋白和细胞因子也参与了胚胎大脑的发展。在植入前胚胎中,细胞因子会影响基因表达,代谢,细胞应激和死亡。出生时,引起这些变化的基因将被沉默。但是,如果通过炎症(炎症)和几十年后病毒在大脑中重新激活,它们可能会破坏子宫内形成的相同神经元结构。
类黄酮的神经保护作用
构成CNS的单元格是不同类型的。例如,神经胶质细胞包括星形胶质细胞,小胶质细胞和少突胶质细胞,可产生介导稳态过程的各种细胞因子和趋化因子(6)。星形胶质细胞产生一些细胞因子,例如IL-17和IFN-,以及趋化因子CCL2(7)。产生周围轴突的髓鞘鞘的少突胶质细胞介导神经元之间的快速信号传导,并且可能是免疫靶标(8)。小胶质细胞是类似于外周血单核细胞的髓样细胞类型,具有吞噬衰减细胞的残留物以及设法越过血脑屏障(BBB)的微生物的功能。活化的小胶质细胞产生多种促炎细胞因子,例如IL-1,TNF和IL-6,损害了CNS(9)。此外,活化的小胶质细胞还产生IL-12和IL-23,即参与细胞碎片和微生物吞噬的细胞因子,从而促进组织再生(10)。
针对KSHV相关疾病的细胞因子靶向治疗
摘要:Kaposi的肉瘤相关疱疹病毒(KSHV)也称为人疱疹病毒8(HHV-8),与几种人类恶性肿瘤有关(KICS)。与具有显着炎症成分的其他疾病一样,针对KSHV相关疾病的当前疗法与明显的核定作用有关。然而,我们对KSHV发病机理的理解的最新进展已对使用细胞因子作为潜在治疗靶点的新见解。更好地了解细胞因子在KSHV感染和肿瘤发生过程中的作用可能会导致新的预防或治疗策略限制KSHV扩散并改善临床结果。由于KSHV抗病毒疗法包括白介素6、10和12,以及干扰素和肿瘤坏死因子家庭因子细胞因子。本综述探讨了我们当前对细胞因子在促进KSHV感染和肿瘤发生中起作用的作用的理解,并总结了当前使用细胞因子作为KSHV相关疾病中的治疗靶标。
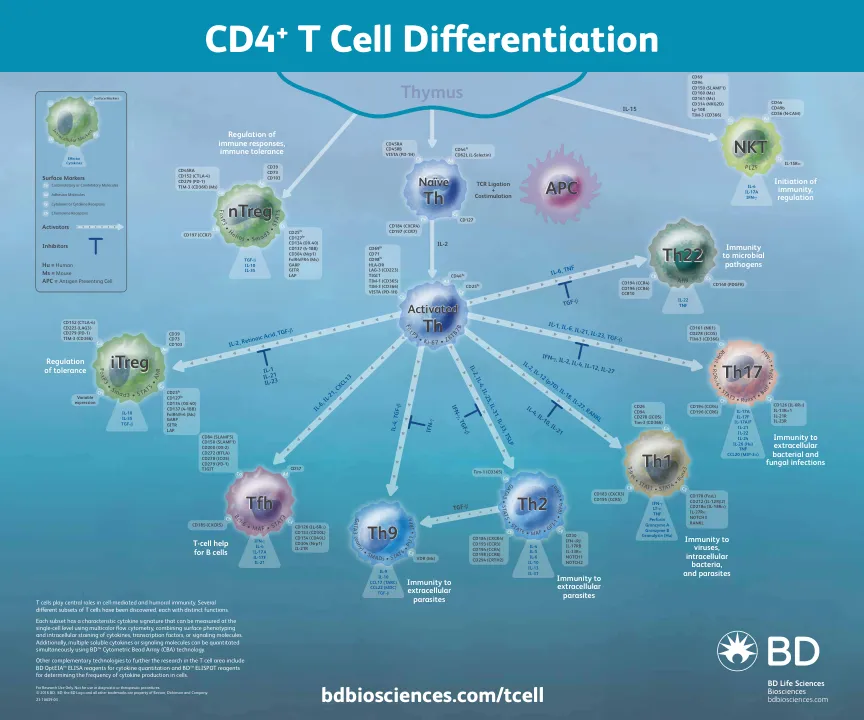
CD4+ T细胞分化海报
每个子集都有一个特征性的细胞因子特征,可以在单细胞水平上使用多色流细胞术在单细胞水平上测量,结合了细胞因子的表面表型和细胞内染色,转录因子或信号分子。此外,可以使用BD™细胞量仪阵列(CBA)技术同时定量多个可溶性细胞因子或信号分子。
溶瘤αHerpesvirus和髓样 - 胶质细胞病毒合作增强了全身抗肿瘤反应
MCMV改善了早期时间点KOS-BAC R4.1(DICP47)的复制(图2a)。然而,超过3个DPT,单一疗法和组合组的KOS-BAC R4.1的复制迅速下降。比较组合组与单一疗法组Q-PCR分析显示,肿瘤内KOS-BAC R4.1基因表达和MCMV表达的下调在3个DPT上的下调(图2b)。细胞因子阵列筛选测定法用于确定组合组与单个药物组中肿瘤内细胞因子的相对水平。在3个DPT上,与其他三组相比,在组合组中略微上调了几种促炎性细胞因子(图2C)。相反,在9 dpt的组合组中,各种促炎性细胞因子上调
通过结合IL-12和IL-2
引言免疫检查点阻滞(ICB)扩展了非小细胞肺癌(NSCLC)的生存(1-4)。但是,大多数NSCLC显示对ICB的主要或次要电阻。一级电阻,而当肿瘤在初始反应后停止对ICB响应时,就会发生二次阻力(5)。当前耐冰公司NSCLC的当前二线疗法几乎没有临床利益(1)。因此,需要改进的耐冰公司NSCLC的治疗方案。临床前研究和回顾性临床分析表明,细胞因子疗法可以使一部分对ICB反应的癌症患者受益(6,7)。与这一概念一致,我们先前发现,可移植的鼠肺肿瘤模型(KRAS G12D p53 –/ - ; kp)对ICB具有抵抗力,但是将IL-12和IL-2融合到Murine血清血清白蛋白(IL12-MSA; IL2-MSA; IL2-MSA)的控制量得到了改善的KP LUNG TAMORS(8)。在此模型中,使用IL12-MSA和IL2-MSA的联合疗法导致肿瘤反应性CD8 + T细胞的强化激活;但是,仅IL12-MSA对响应KP肺肿瘤的CD8 + T细胞没有影响。在这里,我们单独研究了对IL12-MSA的T细胞反应,或在具有KP肺肿瘤的小鼠中与IL2-MSA结合使用,以更好地了解抗冰B的NSCLC的细胞因子介导的T细胞激活和肿瘤控制。IL-2和IL-12都在人类中表现出明显的剂量限制性毒性(9-11),这限制了其临床作用。Molecular engineering approaches have developed multiple strategies for generating cyto- kines with lower dose-limiting toxicity, including shielding cytokines with cleavable domains that prevent their activity until they are released by proteases in the tumor microenvironment (TME) (12) , intratumor- ally injecting modified cytokines fused to anchoring moieties to retain them in the TME to restrict systemic
用于细胞因子检测的全dielectric替代Terahertz生物传感器
细胞因子释放综合征(CRS)是重症患者死亡的重要原因之一[1,2],它是指由于过度激活或失控的免疫系统产生的极端免疫反应,该系统在病毒入侵时会释放出大量细胞因子。细胞因子是一类由免疫细胞分泌的小分子可溶性肽蛋白。临床研究发现,COVID-19重症监护患者的血清促炎细胞因子水平显着升高。白介素2(IL-2)是典型的细胞因子之一[3,4]。在发生严重CRS之前检测患者血清样品中与CRS相关的细胞因子并在炎症反应中进行介入是临床诊断的重要组成部分,这是正确预先确定的治疗指南的重要指南。由于血清中的细胞因子浓度低(PM范围),因此需要高敏性生物传感器才能检测。Terahertz(THZ)超材料生物传感器是一种无损,无标签,高度敏感的传感器,用于PM级细胞因子检测。但是,大多数典型的超材料是金属基阵列结构,而设备的低Q因子限制了由于高金属损耗而引起的传感器的灵敏度。与金属结构的超材料相比,介电的超材料的损失较低,Q因子较高,并且可以用作THZ超材料生物传感器,以显着提高传感器的灵敏度和检测限。Yang创造性地报道了中的基于硅的双间隙拆分结构Yang创造性地报道了考虑了FANO共振,以进一步改善设备的Q因子,例如,基于硅纳米条[5],不对称 - 切割线超材料[6]的介电FANO共振结构[6],以及连续的全dielectric Boundic boundic boundic body态[7]。
DNA甲基转移酶mRNA的外泌体转移诱导人类单核细胞产生免疫抑制表型
脓毒症综合征由细胞和循环调节因子的复杂网络介导 (1, 2)。在急性期,炎症细胞因子(包括 TNF α、IL-1 β 和 IL-6)被释放到循环中,在那里它们介导发烧、白细胞增多、器官衰竭和分布性休克 (3, 4)。与促炎期相伴的是强大的反调节抗炎反应,它抑制炎症细胞因子的产生并抑制先天免疫功能 (5)。该免疫抑制期的主要介质包括 IL-1ra、IL-4 和 IL-10,而 TNF α 和其他促炎介质的基因表达受到抑制 (6, 7)。一些患者表现出称为持续性炎症、免疫抑制分解代谢综合征 (PICS) 的特征性矛盾症状群 (6, 8)。其他患者会出现长期的免疫抑制期,其特征是这些抗炎细胞因子的持续表达、促炎细胞因子的抑制和严重的先天免疫功能障碍(9, 10)。
注射:药物 T 政策
气道炎症是哮喘发病机制中的一个重要组成部分。多种细胞类型(例如肥大细胞、嗜酸性粒细胞、中性粒细胞、巨噬细胞、淋巴细胞、ILC2 细胞)和介质(例如组胺、二十烷酸、白三烯、细胞因子)参与气道炎症。使用 tezepelumab-ekko 阻断 TSLP 可减少与炎症相关的生物标志物和细胞因子,包括血液嗜酸性粒细胞、气道黏膜下嗜酸性粒细胞、IgE、FeNO、IL-5 和 IL-13;然而,tezepelumab-ekko 在哮喘中的作用机制尚未明确。