XiaoMi-AI文件搜索系统
World File Search Systeminvestigational
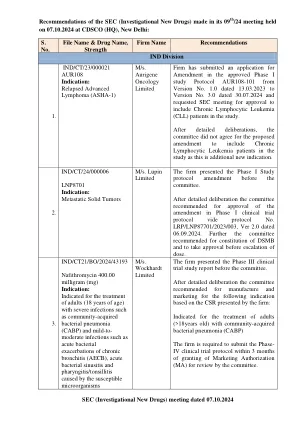
SEC(新药研究)会议于 07.10 举行。......
该公司向委员会提交了第三阶段临床试验研究报告。经过详细审议,委员会根据该公司提交的 CSR 建议生产和销售以下适应症:用于治疗患有社区获得性细菌性肺炎 (CABP) 的成年人 (>18 岁)。该公司必须在获得营销授权 (MA) 后 3 个月内提交第四阶段临床试验方案供委员会审查。
PAN-TB协作以推进研究性结核病药物方案
在2022年8月17日治疗较短的治疗期间,治疗药物敏感和耐药形式 - 加速新的结核病治疗(PAN-TB)合作的项目今天宣布,今天宣布执行共同开发协议(JDA),以支持两个研究性结核病(TB)组合治疗方案的发展,该协议的进展是第二阶段的临床第二阶段的发展。合作将评估结合注册产品和新化学实体(NCE)的新型方案是否可以使用比现有药物方案更短的治疗持续时间有效地处理所有形式的活性肺结核,以确定适合3阶段3阶段开发方案。结核病是全球疾病,残疾和灾难性家庭成本的主要原因,并且是全球传染病的主要死亡原因之一,估计每年造成150万人死亡。一种较短的药物治疗方案,可以在可能的三个月或更短的时间内治疗可抗药的结核病形式和耐药形式,这可能会为患者和卫生系统带来重大好处,并可能克服需要伴随的药物耐药性测试的需求。认识到,没有一个组织能够产生对结核病做出反应所需的全部药物,因此PAN-TB合作将慈善,非营利和私营部门组织汇集在一起,以加快新颖,较短的药物治疗方案的开发,以治疗所有形式的TB。将在新JDA下评估的五种抗菌剂,并且贡献它们的组织包括:
GRIN Therapeutics 将公布 Honeycomb 临床试验数据
纽约,2024 年 11 月 21 日——治疗严重神经发育障碍的疗法开发领域的领导者 GRIN Therapeutics Inc. 今天宣布,它将展示该公司 1b 期 Honeycomb 临床试验的结果,该试验评估了该公司在研的 GluN2B 负变构调节剂 radiprodil 在治疗具有功能获得 (GoF) 变异的 GRIN 相关神经发育障碍方面的效果。海报展示将于 12 月 6 日至 10 日在加利福尼亚州洛杉矶举行的美国癫痫协会 (AES) 年会上举行,还将包括对计划于 2025 年初启动的雷迪普地尔计划中的 3 期临床试验的拟议设计的审查。 展示详情: 标题:药代动力学、安全性/耐受性以及个体滴定雷迪普地尔剂量对 GRIN 相关疾病儿童癫痫发作频率和行为的影响:顶级多中心研究数据 展示者:Pierandrea Muglia 医学博士,GRIN Therapeutics 创始人 会议日期/时间:12 月 7 日星期六,太平洋标准时间下午 12:00 – 6:00 有关会议的更多信息,请访问 AES 网站。关于雷地普地尔:雷地普地尔是一种在研的、选择性的强效负变构调节剂,可作用于 N-甲基-D-天冬氨酸 (NMDA) 受体亚型 2B (NR2B 或 GluN2B)。非临床研究表明,雷地普地尔可有效选择性地调节 NMDA NR2B 或 GluN2B。雷地普地尔还在多种体外和体内临床前癫痫和癫痫模型中表现出抗癫痫作用,特别是在 GluN2B-NMDA 传输增强的模型中,这种现象可能出现在 GRIN 相关神经发育障碍的功能获得 (GoF) 突变中。对从结节性硬化症 (TSC) 和局灶性皮质发育不良 (FCD) 病变中提取的脑组织进行体外分析,结果显示 GluN2B- NMDA 表达增强,支持了雷迪普地尔控制这些疾病中癫痫发作的潜在能力。关于 GRIN Therapeutics:GRIN Therapeutics 致力于研究和开发儿童神经发育障碍的精准疗法,旨在为患者和护理人员带来希望。该公司致力于为神经发育障碍患者开发新型疗法,目前正在进行两项临床试验,以评估雷迪普地尔对 GRIN 相关神经发育障碍和其他神经系统疾病(包括结节性硬化症 (TSC) 和局灶性皮质发育不良 (FCD) II 型)的潜在治疗效果。GRIN Therapeutics 是 Neurvati Neurosciences 的附属公司,后者是 Blackstone Life Sciences (BXLS) 的投资组合公司。欲了解更多信息,请访问 www.grintherapeutics.com。关于 Neurvati Neurosciences
Elenestinib是研究,下一代KIT D816V抑制剂,降低
纽约,纽约; 19挪威奥斯陆Rikshospitalet的奥斯陆大学医院血液学系; 20凯恩·诺曼迪医院中心,法国凯恩的血液学研究所; 21德国汉堡大学汉堡大学医学中心汉堡 - 埃潘多夫; 22意大利帕维亚大学分子医学和血液学和肿瘤学系; 23澳大利亚墨尔本的阿尔弗雷德医院; 24阿拉巴马大学伯明翰,伯明翰,阿拉巴马州; 25蓝图药品公司,马萨诸塞州剑桥; 26瑞士祖格的蓝图药品公司; 27德克萨斯大学医学博士安德森癌症中心,德克萨斯州休斯敦; 28 St John的皮肤病学研究所,盖伊和圣托马斯的NHS基金会信托基金会,英国伦敦; 29过敏性疾病分裂,蛋黄酱
Kinnate Biopharma Inc.出售其研究性Pan-Raf抑制剂
•Kinnate已与Pierre Fabre Laboratories签订了一项资产购买协议(“ APA”),以全球授予Exarafenib和其他Pan-Raf计划资产。•交易是为了促进Kinnate先前宣布的战略替代方案。•此次收购旨在使皮埃尔·法布尔(Pierre Fabre)实验室能够在精确肿瘤学领域进行努力,并为其范围扩大其范围,以扩大需要RAF和RAS实体瘤中有针对性疗法的患者的影响力。旧金山,圣地亚哥和康斯特斯(法国) - 2024年3月1日 - Kinnate Biopharma Inc。(NASDAQ:KNTE)(“ Kinnate”或“ Company”),一家临床阶段的精确肿瘤学公司,以及SAS的Pierre FabreMédicament(“ Pierre Fabre Laboratories”),肿瘤学的全球参与者,今天宣布宣布与该公司的PAN-RAF-RAF-RAF-RAF-RAF-RAF-RAFFINEDIB的同意,并宣布其同意。各方。全球权利的出售是为了促进该公司先前宣布的战略替代方案的探索。“我们很高兴与Pierre Fabre Laboratories合作。来自Kinnate的Exarafenib和其他PAN-RAF计划资产与我们现有的BRAF和MEK抑制剂组合与Encorafenib和Binimetinib互补。此外,Pierre Fabre实验室最多将承担$ 5“将Exarafenib和我们的Pan-Raf计划资产出售给Pierre Fabre将在全球范围内扩大这些计划的影响力,从而有望为NRAS驱动的黑色素瘤患者和BRAF驱动的实体瘤对有针对性的疗法进一步发展。” “基于迄今为止生成的临床和临床前数据,我们认为Exarafenib可能会呈现一流的产品概况,作为靶向实体瘤(例如NRAS突变型黑色素瘤)的PAN-RAF抑制剂,目前尚无批准的靶向靶向疗法。这次收购继续扩大我们在精确肿瘤学方面的努力,并为我们提供了向需要在RAF和RAS实体瘤中有针对性疗法的患者扩大覆盖范围的机会。” Pierre Fabre Laboratories。根据APA的条款,Pierre Fabre实验室购买了Exarafenib和其他Pan-Raf资产,并将承担100%正在进行的计划以及与这些资产相关的成本。In consideration, Kinnate will receive a total consideration of up to $31 million, consisting of $500,000 at closing, and a $30.5 million payment, contingent upon the earlier of the dosing of the first patient in the first pivotal trial for exarafenib or any other acquired asset, or the application for an accelerated approval pursuant to the FDA's Accelerated Approval Program for exarafenib or any other acquired资产,或提交exarafenib或任何其他获得资产的监管机构批准的营销申请。
● Nuvisertib (TP-3654) 是一种口服高选择性 PIM1 激酶抑制剂,
马萨诸塞州马尔伯勒,2024 年 11 月 6 日 — 住友制药美国公司 (SMPA) 今天宣布,将在 2024 年 12 月 7 日至 10 日于加利福尼亚州圣地亚哥举行的第 66 届美国血液学会 (ASH) 年会暨博览会上发表三篇演讲。演讲将包括支持 nuvisertib 的新临床数据,nuvisertib 是一种正在研究用于治疗复发/难治性骨髓纤维化 (MF) 的试验性小分子,以及 enzomenib,一种正在研究用于治疗复发/难治性急性白血病的试验性口服小分子。正在进行的 nuvisertib 1/2 期研究的结果继续支持 nuvisertib 单药治疗耐受性良好,没有剂量限制性毒性 (DLT) 并且早期临床活动前景光明。目前,这项全球研究正在扩大,以评估 nuvisertib 与 JAK 抑制剂芦可替尼(首个获批的 JAK 抑制剂)和 momelotinib(最近获批用于治疗贫血症 MF 患者的 JAK 抑制剂)的联合使用,以评估安全性和临床活性。此外,来自 enzomenib 1/2 期研究的新临床数据显示,在广泛治疗剂量范围内的患者中,该疗法均表现出有希望的临床活性,并且安全性数据令人鼓舞,因为 enzomenib 耐受性良好,未观察到 DLT 或因与 enzomenib 相关的不良事件而停药的案例。SMPA 肿瘤科首席医疗官 Jatin Shah 医学博士表示:“对于复发性 AML 或骨髓纤维化患者,迫切需要新的有效治疗方案,以显著改善这些癌症相关的不良预后。这些数据让我们备受鼓舞,我们将继续快速推进复发/难治性 MF 和急性白血病的开发项目。” “我们期待在 12 月即将召开的会议上分享最新结果,这进一步支持 nuvisertib 和 enzomenib 的开发,并将继续致力于推进我们产品线中的新发展。”
复发性或原发性晚期转移性宫颈癌的在研药物:
a 妇产科、妇科肿瘤科、鲁汶癌症研究所、天主教鲁汶大学、比利时鲁汶;比利时和卢森堡妇科肿瘤学组(BGOG)、比利时鲁汶、欧盟;b 肿瘤医学系、莱昂贝拉德中心和里昂第一大学、GINECO、法国里昂;c 妇科肿瘤科、天主教圣心大学和 Fondazione Policlinico Gemelli IRCCS、意大利罗马;d 妇科癌症项目、Vall d'Hebron 肿瘤研究所(VHIO)、大学医院 Vall d'Hebron、Vall d'Hebron 巴塞罗那医院校区、巴塞罗那;e 妇产科、捷克共和国布拉格查理大学和布拉格综合大学医院第一医学院捷克共和国布拉格中欧和东欧妇科肿瘤组 (CEEGOG)
医疗政策 - 实验室测试 - 遗传,分子和其他测试 - 实验/研究
实验/研究状态描述/背景美国食品药品监督管理局将实验室测试定义为旨在用于血液,尿液或其他组织或从体内的物质的医疗设备,以帮助诊断疾病或其他疾病。1个实验室测试可以检测分析物的存在,不存在或数量。其他测试揭示了基因的突变或传染性生物的存在。尽管我们有测试数千种化学物质或遗传物质的技术,但并非每个实验室测试都确定在医疗中有用或必要。本政策表1中列出的1个测试在相关的医疗政策或政策中讨论或列出。本政策是根据医疗政策状态对已审查并确定为实验或研究的测试名称的汇编。监管状况临床实验室可能会在内部开发和验证测试,并将其作为实验室服务销售;实验室开发测试(LDT)必须符合《临床实验室改进法》(CLIA)的一般监管标准。提供LDTS的实验室必须获得CLIA的许可,以进行高复杂性测试。迄今为止,美国食品药品监督管理局已选择不需要对这些测试进行任何监管审查。
复发性或原发性晚期转移性宫颈癌的在研药物:
a 妇产科、妇科肿瘤科、鲁汶癌症研究所、天主教鲁汶大学、比利时鲁汶;比利时和卢森堡妇科肿瘤学组(BGOG)、比利时鲁汶、欧盟;b 肿瘤医学系、莱昂贝拉德中心和里昂第一大学、GINECO、法国里昂;c 妇科肿瘤科、天主教圣心大学和 Fondazione Policlinico Gemelli IRCCS、意大利罗马;d 妇科癌症项目、Vall d'Hebron 肿瘤研究所(VHIO)、大学医院 Vall d'Hebron、Vall d'Hebron 巴塞罗那医院校区、巴塞罗那;e 妇产科、捷克共和国布拉格查理大学和布拉格综合大学医院第一医学院捷克共和国布拉格中欧和东欧妇科肿瘤组 (CEEGOG)