XiaoMi-AI文件搜索系统
World File Search Systeminvestigational
2025年2月20日委员会主席C
保护人类受试者。合格的患者是一个人:!患者的医生证明了一种威胁生命或严重使人衰弱的疾病;呢考虑了美国食品药品监督管理局目前批准的所有其他治疗方案;呢收到了患者治疗医师的建议;呢给予书面,知情同意,以使用个性化的研究药物,生物产品或装置;和 !从治疗医师那里得到的文件,即个人符合“合格患者”的定义。该法案授权但不需要制造商将个性化的研究药物,生物产品或符合条件的患者免费提供的设备,但制造商可能需要付款来支付费用。如果使用个性化的研究药物,生物产品或设备对符合条件的患者造成了任何伤害,则不能对制造商或任何其他个人或实体对符合条件的患者的护理涉及合格的患者使用合格的患者使用个人化的研究药物,生物学生物,或者进行制造业的个人,或者对符合条件的患者的使用,或者对符合条件的患者的使用,或者对制造业的个人进行了反驳,或者对符合条件的患者的使用。该法案禁止根据医疗保健提供者对使用个性化研究药物,生物产品或设备的使用的建议,禁止对医疗保健提供者的执照采取任何行动。该法案中没有任何任何影响保险公司根据现行法律的义务,与被保险人参与临床试验的覆盖范围有关。
ONWARD® Medical 重申指引,分享 2024 年...
• ARC-EX 商业发布。公司预计将于 2024 年第四季度在美国推出其在研的 ARC-EX 疗法,用于改善脊髓损伤后上肢的力量和功能。今年的主要相关里程碑包括 FDA De Novo 提交、FDA 批准和首次商业销售。• ARC-IM 关键研究开始。公司打算启动其全球关键研究 Empower BP,用于在研的 ARC-IM 疗法,以解决脊髓损伤后的血压不稳定问题。今年的主要相关里程碑包括 FDA IDE 提交、FDA IDE 批准和第一批参与者招募。• ARC-BCI 疗法进展。公司计划利用拨款资金和最近宣布的 FDA 突破性设备指定以及 FDA 新 TAP 计划的接受,推进其在研 ARC-BCI 系统的临床和开发活动。
PGY1药房居住 - Aurora Health Care Metro,Inc。
Informatics药剂师协调员药学学院:伊利诺伊大学 - 芝加哥大学其他培训:PGY1辛辛那提VA医疗中心的PGY1药房住院医师和Aurora Health Care的PGY2药学信息居住; Teaching Certificate from the University of Cincinnati James L. Winkle College of Pharmacy Practice Areas and Specialties: Pharmacy Informatics, Inpatient Medication Build Previous Practice Areas and Positions: Pharmacy Informatics Pharmacist for Ambulatory Clinic Workflows at Cleveland Clinic, Pharmacy Informatics Pharmacist for Investigational Medication Workflows at Mayo Clinic Sites Precepting At: Advocate Health Remote – Willow Information Technology Residency Program Involvement:电子健康记录I学习经验和PGY2 Informatics Residency Rescency Rependics计划
针对严重衰弱或危及生命的疾病的个体化反义寡核苷酸药物产品的非临床试验
鉴于本指南涵盖的试验性反义寡核苷酸将仅用于少数患有 SDLT 疾病的个体,建议用于支持首次人体 (FIH) 暴露的非临床安全性 43 包通常不如用于开发旨在更广泛使用或在不太严重的临床情况下使用的反义寡核苷酸产品时通常建议的广泛。 3 为了抵消由于数据有限而导致的更大风险假设,重要的是申办方提供令人信服的体外和/或体内概念验证 (POC) 数据,作为任何试验前新药 (pIND) 会议 48 包或原始试验性新药 (IND) 提交的一部分(如果没有要求 49 前 IND 会议),用于本指南涵盖的试验性反义寡核苷酸。这些数据对于支持成人和儿科受试者的潜在益处非常重要。 51
GMO 注册号 G0876
请参阅 GMO 申请,GMO 注册号 G0876-01,用于研究 ITL-3001-CL-101,该申请已于 2024 年 12 月 19 日获得机构批准。Intellia Therapeutics, Inc.(Intellia,赞助商/GMO 通知人)特此通知机构,由于优先考虑其他赞助商项目,撤回临床试验 ITL-3001-CL-101,用于研究产品 NTLA-3001。NTLA-3001 是一种基于 AAV8 和 CRISPR/Cas9 的体内基因编辑研究疗法,用于治疗患有 alpha-1 抗胰蛋白酶缺乏症 (AATD) 相关肺病的成年人。
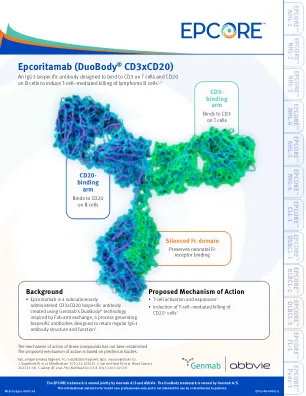
epcoritamab(duobody®CD3XCD20)-Genmab
• Primary CNS lymphoma or CNS involvement • Known past or current malignancy other than inclusion diagnosis • Autoimmune or other diseases resulting in permanent immunosuppression or immunosuppressive therapy • Seizure disorder requiring therapy (eg, steroids or anti-epileptics) • Any prior therapy with an investigational bispecific antibody targeting CD3 and CD20 • Prior treatment with CAR T therapy within 30 days of first epcoritamab administration • Eligible for curative intensive salvage therapy followed by high-dose chemotherapy with HSCT rescue • Autologous HSCT within 100 days of first epcoritamab administration, or any prior allogeneic HSCT or solid organ transplantation • Active hepatitis B or C infection (evidence of prior hepatitis B virus but PCR-negative is permitted) or known HIV infection