XiaoMi-AI文件搜索系统
World File Search Systempembrolizumab
免疫检查点抑制剂
可用。NMA 显示,在所有分析的比较(总体人群和 IMDC 风险亚组)中,卡博替尼 + 纳武单抗均优于阿昔替尼 + 帕博利珠单抗和纳武单抗 + 伊匹单抗,无论是在总生存期还是无进展生存期 (PFS) 方面。在总体人群中,与纳武单抗 + 伊匹单抗相比,卡博替尼 + 纳武单抗的优势仅在于 PFS 具有统计学意义。卡博替尼 + 纳武单抗与仑伐替尼 + 帕博利珠单抗的比较结果显示,仑伐替尼 + 帕博利珠单抗组合在总生存期方面具有数值优势,但所有结果均不具有统计学意义。在总体预后良好的人群中,仑伐替尼 + 帕博利珠单抗相对于卡博替尼 + 纳武单抗的 PFS 优势具有统计学意义。
表 1.临床试验资格概述
NRG-GY018 RUBY AtTEnd KEYNOTE-B21 DUO-E 免疫检查点抑制剂 抗 PD-1 抗体 抗 PD-1 抗体 抗 PD-L1 抗体 抗 PD-1 抗体 抗 PD-L1 抗体 帕博利珠单抗 dostarlimab 阿特珠单抗 帕博利珠单抗 durvalumab
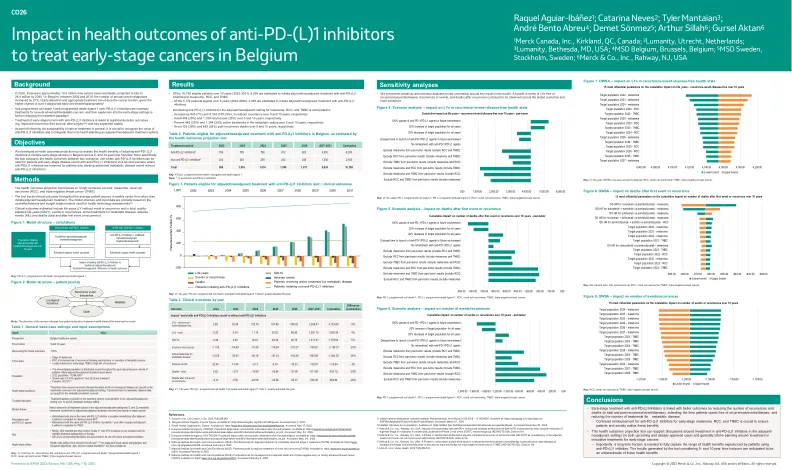
对比利时治疗早期癌症抗PD-(L)1抑制剂的健康结果的影响
9。国民医学研究所疾病。Pembrolizumab,Arret Royal 01.02.2018 - IV 8090000。可用:https://webappsa.riziv-inami.fgov.be/sspwebapplicationpublic/fr/public/productionearch。2023年3月21日访问。10.Statbel。结构de la人口。可用:https://statbel.fgov.be/fr/fr/themes/population/structure-de-la-population#news。2022年11月23日访问。11.Merck&Co.,Inc。,美国新泽西州拉威。用抗PD-1单克隆抗体Pembrolizumab(MK-3475)与安慰剂进行辅助免疫疗法,在完全切除高风险的III期黑色素瘤:EORTC黑色素瘤组的一项随机,双盲期3期试验(Keynote-054)。文件中的数据。12.Merck&Co.,Inc。,美国新泽西州拉威。第3阶段,随机,双盲,安慰剂对照的临床试验(MK-3475)作为肾脏肾上腺切除术后肾细胞癌(Keynote-564)的辅助治疗中的单一疗法。文件中的数据。13.Merck&Co.,Inc。,美国新泽西州拉威。一项III期,随机的双盲研究,用于评估pembrolizumab加化学疗法与安慰剂以及化学疗法作为新辅助治疗和pembrolizumab vs安慰剂作为三重负乳腺癌(TNBC)的辅助治疗(Keynote-522)。文件中的数据。14.ARA R等。价值健康。2010; 13(5):509-518。2010; 13(5):509-518。
BC癌症协议摘要 - 新辅助...
资格:患者必须具有:可切除的皮肤,丙氨酸或粘膜黑色素瘤,临床可检测到的临床可检测到的淋巴结疾病,或者在介绍时可切除的转移性疾病有限[即IIIB到IIIB或IIIIS或IIII IIIIS或IIIIS或寡聚期IV期IV期IV(M1A,M1B和M1B和M1C)的效果(M1B和M1B)的疗法,并疗法为8 th the Edition and untist and untist and Edition],并且是Edition and Edities。足够的基线血液学,肝功能和肾功能进入具有管理免疫疗法的专业知识的治疗中心介导的Pembrolizumab的毒性,pembrolizumab的毒性注释:pembrolizumab的三个周期应在术前进行术前接受(新辅助治疗阶段),除非需要进行6个周期的临床批准,否则需要进行临床批准,否则需要进行临床批准,否则需要进行临床批准。 pembrolizumab术后(辅助治疗阶段)。Do not switch to 6- weekly dosing during neoadjuvant treatment phase Patients may have subsequent checkpoint inhibitors for advanced disease if last adjuvant pembrolizumab dose was > 6 months prior EXCLUSIONS: Patients must not have: Uveal or ocular melanoma CAUTIONS: Concurrent autoimmune disease Patients with long term immunosuppressive therapy or systemic corticosteroids (requiring超过10 mg泼尼松/天或同等的)
免疫疗法治疗方案的指南和...
•nivolumab + ipilimumab(PD-L1TC≥1%批准的指示; NCCN:任何PD-L1)Nivolumab + ipilimerab + 2个铂 - doublet-Doublet化学疗法Pembrolizumab的循环NAB-丙甲酰胺(鳞状NSCLC)atezolizumab + bevacizumab/paclitaxel/paclitaxel/carboplatin(非鳞)atezolizumab + nab-paclitaxel/carboplatin(非quamous)
Cadth报销建议
Evidence from one open-label phase III randomized controlled trial involving a total of 886 patients with locally advanced or metastatic urothelial cancer (Study EV-302) showed that treatment with enfortumab vedotin in combination with pembrolizumab demonstrated a clinically meaningful benefit compared to platinum plus gemcitabine chemotherapy (PLAT + GEM) in improving overall survival (HR: 0.468 [95% CI: 0.376,0.582]; p <0.00001),无进展生存率(HR = 0.450,95%CI:0.377,0.538; p <0.00001)和客观响应率(差异= 23.3%[95%CI,16.8%至29.6%];Enfortumab Vedotin与Pembrolizumab结合使用的安全性与Enfortumab Vedotin单一疗法和pembrolizumab单一疗法的已知安全概况一致。
BC癌症方案摘要用于使用atezolizumab和bevacizumab
注意:•目前正在研究接受免疫疗法的患者的疫苗接种安全性和功效2-5•避免在开始pembrolizumab之前,避免使用全身性皮质类固醇或免疫抑制剂,原因是由于潜在的干扰pembrolizumab的功效; corticosteroids or immunosuppressants may be used during treatment with pembrolizumab for the management of immune-mediated adverse reactions 6 • patients who may receive or have received allogeneic hematopoietic stem cell transplantation before or after retifanlimab treatment may be at increased risk of serious complications from their transplant, including graft- versus-host disease and sinusoidal obstruction syndrome 1 • solid organ transplant rejection has在接受其他PD-1抑制剂治疗的患者中报道了6
CADTH 报销建议
一项国际性、双盲、随机、 III 期临床试验 (KEYNOTE-966,N = 1,069) 纳入了局部晚期、不可切除或转移性 BTC 患者,且该类患者此前未接受过治疗,结果表明,与安慰剂加吉西他滨和顺铂(以下简称安慰剂加化疗)相比,使用帕博利珠单抗加吉西他滨和顺铂(以下简称帕博利珠单抗加化疗)治疗可能会显著提高总生存期 (OS) 的概率。帕博利珠单抗联合化疗组的中位 OS 为 12.7 个月(95% 置信区间 [CI]:11.5 至 13.6),安慰剂联合化疗组为 10.9 个月(95% CI:9.9 至 11.6),风险比 (HR) 为 0.83(95% CI:0.72 至 0.95)。12 个月和 24 个月的 Kaplan-Meier (KM) 估计的 OS 率的组间差异分别为 7.5%(95% CI:1.6 至 13.4)和 6.8%(95% CI:1.7 至 11.9),因此表明帕博利珠单抗联合化疗具有生存优势。健康相关生活质量 (HRQoL) 评估表明,与单纯化疗相比,在化疗中添加帕博利珠单抗可能不会产生任何有临床意义的差异;但由于 HRQoL 评估中缺少大量数据,因此证据的确定性较低。
Enfortumab Vedotin(Padcev)
1 项开放标签 III 期随机对照试验 (RCT) 涉及共 886 名局部晚期 UC 或 mUC 患者(研究 EV-302),其证据表明,与铂类加吉西他滨化疗相比,enfortumab vedotin 联合 pembrolizumab 治疗在改善 OS(风险比 [HR] = 0.468;95% 置信区间 [CI],0.376 至 0.582;P < 0.00001)、无进展生存期 (PFS) (HR = 0.450;95% CI,0.377 至 0.538;P < 0.00001) 和客观缓解率 (ORR) (差异 = 23.3%;95% CI,16.8% 至 29.6%;P < 0.00001) 方面具有临床意义的益处,且具有高度确定性。 Enfortumab vedotin 与 pembrolizumab 联合治疗的安全性与 enfortumab vedotin 单药治疗和 pembrolizumab 单药治疗的已知安全性一致。