XiaoMi-AI文件搜索系统
World File Search System改进高风险医疗器械的临床调查和评估:CORE-MD(医疗器械协调研究与证据)的原理和目标
整个欧盟 (EU) 都共享有关医疗器械的法规,但制造商是否符合其要求的验证工作则下放给受其国家监管机构(或“主管当局”)监督的独立公告机构。欧盟委员会的作用是与国家监管机构一起实施医疗器械法规 (MDR) 1。与世界上一些其他司法管辖区不同,欧盟缺乏自己的中央科学部门,该部门在每个主要临床领域都拥有医学专业知识。高风险植入式医疗器械对于临床护理至关重要。在进入市场之前,对临床证据的审查也是必不可少的。对所适用标准的不确定性 2 以及对某些器械在临床证据不足的情况下获准进入市场的担忧,促使人们一致认为需要制定新的欧盟法规。3 心脏瓣膜、金属对金属髋关节置换术、乳房植入物和手术网片等问题进一步强化了这种看法。或许因此,MDR 提高了在批准新的高风险器械之前对临床证据的要求。此前,欧盟的市场准入速度比美国更快 4 ,但现在设备开发商担心欧盟体系可能会变得不那么可预测,而且更加耗时。确定新设备获批前应提供何种程度的临床证据的最佳方法是通过科学研究。因此,为了获得有关临床研究适当方法和标准的专家建议,欧盟委员会于 2020 年发布了一份研究征集,题为“开发方法以改进高风险医疗器械的临床研究和评估”。 5 本文阐述了获得此项资助的项目的理由和目标。我们概述了计划的主要任务,并描述了同事如何为其活动做出贡献。
IVMC-综合血管管理诊所
心脏功能诊所 - 心力衰竭 - CHF是我们老龄化社会的健康问题。不幸的是,心力衰竭的预后不良,生存率比许多形式的癌症都差。但是,新的疗法正在帮助改善这种情况,并精心结构的心力衰竭诊所为优化护理提供了途径。在KCC中,我们的护士专家专注于该患者人群,并与血管医生合作,以优化患者护理的各个方面。他们还与KCC植入心脏器械诊所的护士专家合作,因为许多心力衰竭患者还需要除颤器,起搏器和心脏重新同步设备。心力衰竭转诊通常来自急诊室,出院和家庭健康团队。
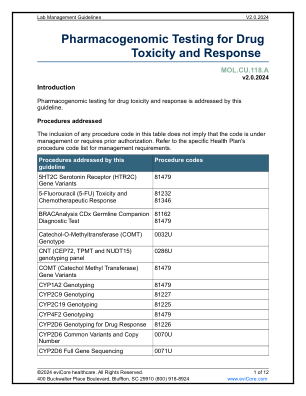
药物毒性和反应的药物基因组学检测
伴随诊断是帮助确定某种药物对特定个体是否安全或有效的检测方法。伴随检测是美国食品药品管理局 (FDA) 新药开发和审批流程的一部分。FDA 表示,“伴随诊断是一种医疗器械,通常是体外器械,它提供对相应药物或生物制品的安全有效使用至关重要的信息。该检测可帮助医疗保健专业人员确定某种治疗产品对患者的益处是否大于任何潜在的严重副作用或风险。”1 虽然 FDA 标签上可能会注明特定的伴随诊断检测以批准新药,但由 CLIA 认证实验室执行的类似实验室开发检测 (LDT) 普遍被接受为可提供所需信息的替代方案。
AI和网络安全 - 从欧洲的角度赌博
On cybersecurity of AI, the EU AI Act provides for so-called ‘conformity assess ments' to determine whether high-risk AI systems are cyber compliant with the EU Regulation on horizontal cybersecurity requirements (the Cyber Resilience Act Regulation (EU) 2024/2847), which involve considering “risks to the cyber resilience of an AI system as regards attempts by unauthorised改变其使用,行为或绩效的第三方,包括AI特定的漏洞,例如数据中毒或对抗性攻击以及基本权利的风险。”公司还可以自愿选择该法案第15条中规定的《 AI法》的网络安全计划。在任何情况下,公司都必须确保在高风险的AI系统中,使用的器械包含《欧盟AI法案》中规定的Cyberse Curity水平。
NSS SA 期末考试信息
第一阶段考试的每次考试将包括约 200 道四部分多项选择题,可能附有图像(X 光片、临床照片/标本、牙科器械和材料等)。考试时间将为 90 分钟,各部分之间有休息。确切的时间表将在考试日期前提供给符合条件的考生。第一阶段考试旨在评估与兽医牙科相关的科学文献知识,包括口腔诊断和治疗计划、对解剖学、材料、用品和设备的熟悉程度,以及与兽医牙科相关的主题的治疗判断,如下面的考试内容表所述。第一阶段考试中的大型动物和外来动物问题将不超过 10%。
Barbervax 巴伯氏杆虫疫苗 90013/127053
注意;避免胴体损坏 1. 使用前,将所有注射器具在水中煮沸 10 分钟(或同等时间)进行消毒。不要对器械使用强力消毒剂。 2. 接种疫苗期间始终保持清洁。必须小心避免疫苗、针头和注射器内部零件与未消毒的表面或未洗过的手接触而受到污染。 3. 保持针头锋利清洁。经常更换。 4. 使用最短的针头,不超过 15 毫米。 5. 避免在潮湿天气或多尘条件下给动物注射。 6. 本产品只能注射到皮下。 7. 在耳朵后面的颈部高处注射。不要在任何其他地方注射。小羊羔可以在被束缚在羊圈中时接种疫苗。
外科技术
必修课程 (52 小时) 学分 小时 BIO 121 解剖学和生理学 I . . . . . . . . . . . . . . . . . . . 4 BIO 122 解剖学和生理学 II . . . . . . . . . . . . . . . . . . . . 4 BIO 123 微生物学 . . . . . . . . . . . . . . . . . . . . . . . . 4 SUR 116 外科术语 I . . . . . . . . . . . . . . . . . . . . . 1 SUR 118 外科术语 II . . . . . . . . . 1 SUR 130 外科器械 . . . . . . . . . 1 SUR 150 个人与职业关系 . . . . . . 1 SUR 158 外科技术人员药理学 . . . 1 SUR 170 无菌处理 . . . . . . . . . . . . . .. 3 SUR 210 外科专业 I .. . . . . . . . . . . . . . . . . . . . . . . . . 5 SUR 231 临床理论 I . . . . . . . . . . . . . . . . . . . . . . . . . . 2 SUR 232 临床实习 I . . . . . . . . . . . . . . . . . . . . . . . . 3 SUR 238 模拟手术室实验室 I . . . . . . . . . . . . . . . . 0.5 SUR 239 模拟手术室实验室 II . . . . . . . . . . . . . . 0.5 SUR 254 外科专业 II . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5 SUR 273 临床理论 II . . . . . . . . . . . . . . . . . . . . . . . . . 2 SUR 274 临床实习 II . . . . . . . . . . . . . . . . . . . . 8 SUR 275 临床实习 III。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 。 6
2025 年 CPT 编码更新 - PBS 放射科业务
• 76014 :由经过培训的临床工作人员对 MR 安全植入物和/或异物进行评估,包括从适当来源(例如手术报告、影像报告、医疗器械数据库、器械供应商、先前影像审查)识别和验证植入物组件,分析各个组件和系统的当前 MR 状况,并咨询已发布的专业指导意见并提交书面报告;最初 15 分钟(仅收取技术费用) • +76015 :每增加 30 分钟,最多 3 个单位(仅收取技术费用) • 76016 :由负责 MR 程序安全的医生或其他合格医疗保健专业人员进行 MR 安全性确定,包括审查指示的 MR 检查的植入物 MR 状况、分析进行 MR 检查的风险与临床益处、确定 MR 设备、附件设备和进行检查所需的专业知识,并提交书面报告
牙髓微生物学
原发性感染中不存在的微生物在专业干预后进入根管系统,会引起继发性根管内感染。微生物的进入可能是在治疗期间、就诊间隔期间,甚至是根管充填后。涉及的种类可能是口腔或非口腔微生物,具体取决于感染的原因。治疗期间微生物进入根管的主要原因包括牙冠上残留的牙菌斑、牙结石或龋齿;橡皮障漏水;或根管器械、冲洗液或其他根管内药物受到污染。微生物可能在就诊间隔期间通过临时修复材料的丢失或泄漏、牙齿结构断裂以及留有引流口的牙齿进入根管系统。根管充填后,微生物也可能通过临时或永久修复材料的丢失或泄漏、牙齿结构断裂、复发性龋齿暴露根管充填材料或延迟放置永久修复体进入根管系统。