XiaoMi-AI文件搜索系统
World File Search System新型假单胞菌产物在体外刺激气道上皮细胞中的白介素-8
由于在囊性纤维化患者的痰中发现了高浓度的IL-8,因此我们假设铜绿假单胞菌(PA)诱导呼吸道上层细胞和单核细胞中IL-8的产生。因此,我们与人类转化的支气管上皮细胞(16-HBE)或单核细胞一起孵育了PA培养物的植物。已与PA超代孵育6小时的16-HBE细胞的培养物具有趋化活性,该抗体受到对人IL-8的抗体的抑制。PA上清液诱导原代支气管上皮细胞,16-HBE细胞和单核细胞产生IL-8。与PA上清液孵育后,16-HBE细胞显示IL-8基因表达水平显着升高。负责IL-8生产的PA产品抵抗冻结,沸腾和蛋白水解。该产品不可提取脂质,并且存在于1 kD滤液中。我们得出的结论是,PA的小分子质量产物刺激了16-HBE细胞和单核细胞的IL-8产生,并且在Expo-DA后16-HBE产生的趋化活性主要归因于IL-8。(J.Clin。投资。1994。93:26-32。)关键词:上皮 - 细胞因子表达 - 囊性纤维化 *内毒素 *趋化性
lncRNA HULC-MIR-556-5P轴通过AMPK/FOXO3途径调节心脏微血管内皮细胞功能
用1%RIPA裂解缓冲液(Elabscience Biotechnology Co.,Ltd,Ltd,Wuhan,中国)提取HCMEC的总蛋白质,并具有磷酸化抑制剂(MCE)。蛋白质浓度,并通过12%SDS-PAGE分离30 µg蛋白质样品,然后转移到PVDF膜(Millipore,Billerica,MA,美国)。在室温下用5%非脂肪干牛奶用5%的非脂肪干牛奶阻塞膜,并在4°C下与一抗的一抗孵育过夜。随后,将膜与相应的二抗在室温下孵育2小时。使用增强的化学发光检测系统(ECL系统; Millipore,Billerica,MA,USA)可视化的蛋白质条带。ImageJ软件用于量化Western blot数据。
空气后评估可用LYO的BST DNA聚合酶稳定性...
图1。在25°C长时间储存后,气干和冻干的Lyo准备的BST DNA聚合酶的聚合酶活性的稳定性。在25°C下孵育13周,将气干和冻干的lyo准备的BST DNA聚合酶样品孵育13周。聚合酶活性:冻干酶(紫色)的气干配方(红色)和0、4和13周的0、2、4、8和13周。在干燥之前将干样品的聚合酶活性与对照酶的聚合酶活性进行了比较,该聚合酶在干燥之前储存在–20°C下,并计算了活性比。重复三个测量值,并计算了标准偏差。水平趋势线(虚线)表示存储期间的稳定性最小。
氢溴酸沃替西汀通过靶向JAK2和SRC抑制体内和体外胃癌细胞的生长
将细胞(4.5×10 6 )接种于15 cm培养皿中,用不同浓度的氢溴酸沃替西汀(0、0.5、1、2和4 µM)处理24小时。然后收集细胞并用RIPA缓冲液裂解。使用BCA试剂盒(BCA蛋白质测定试剂盒,碧云天生物科技,上海,中国)检测蛋白质浓度。将蛋白质样品与蛋白质上样缓冲液在100°C下加热5分钟,然后通过SDS-PAGE分离并转移到PVDF膜上。用5%脱脂牛奶封闭膜1.5小时,在4°C下与一抗孵育过夜。接下来,将膜与相应的二抗孵育1.5小时。使用化学发光试剂(ECL,美伦生物)检测蛋白质结合。Pull-down分析
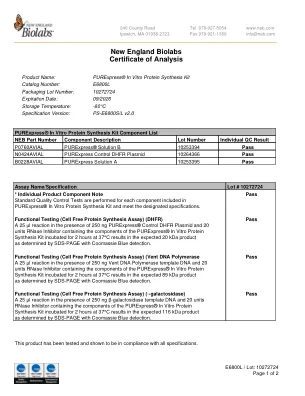
新英格兰Biolabs分析证书
在250 ngPurexpress®对照DHFR质粒的存在下 25 µL反应和20个单位RNase抑制剂,其中含有purexpress®在体外蛋白质合成试剂盒中的成分,在37°C下在37°C下孵育2小时,在预期的20 kda产物中,由SDS-PAGE与COOMASS-PAGE与COOMASS-PAGE确定,在预期的20 kda产物中。25 µL反应和20个单位RNase抑制剂,其中含有purexpress®在体外蛋白质合成试剂盒中的成分,在37°C下在37°C下孵育2小时,在预期的20 kda产物中,由SDS-PAGE与COOMASS-PAGE与COOMASS-PAGE确定,在预期的20 kda产物中。
自我装饰 - via-surface Inipiated-enzymatic- ...
图3(a):荧光Cy5与N3功能化PPEGMA的共轭方案。(b)Cy5偶联细胞的CLSM显微照片。(c):酶结合的方案(例如β-gal)到PEGMA和随后的聚合。请注意,某些酶可能会偶联到一个以上的PPEGMA链中,从而有效地交联了聚合物。(d):β-GAL结合酵母的活动%(吸光度405 nm / OD 600)。(e):β-gal结合的酵母(YPL)孵育的β-gal偶联酵母。(f):与OG 25 mm一起孵育的β-gal偶联酵母的%OD 600。显示为SD的错误条,n = 3重复。**:p <0.01,***:p <0.001。比例尺:5 µm(PEGMA-N 3),10 µm(其他显微照片)。
纳米级流式细胞仪基于血液的定量 -
与对照组相比,在阿尔茨海默氏病等离子体样本中标记更多EV的单个标记。荧光标记针对所指定蛋白的抗体与来自对照,MCI或阿尔茨海默氏病的个体(分为轻度,中度和严重类别)的对照组,患者的血浆样品孵育。每个数据点表示三份孵育的平均值。使用prism 9(GraphPad)与Kruskal – Wallis,Dunn事后检验进行多重比较进行统计比较,并将显着性值设置为p <0.05。aβ,淀粉样β;电动汽车,细胞外囊泡; LAMP1,溶酶体相关的膜蛋白1; MCI,轻度认知障碍; Ptau,磷酸化的tau; SEM,平均值
因子VIII抑制剂试剂盒
FVIII抑制剂试剂盒用于为Nijmegen-Bethesda分析1的疾病控制和预防中心(CDC)修改样品1。因子VIII(FVIII)抑制剂是以时间和温度依赖性方式中和FVIII活性的抗体。在Nijmegenbethesda分析的CDC修饰中,进行了测试血浆的热失活以使内源性FVIII失活,从而使任何FVIII抑制剂抗体保持完整。然后将灭活的测试血浆与外源FVIII源(咪唑缓冲汇总的正常血浆)一起孵育,在此期间,如果存在FVIII抑制剂(如果存在),将逐渐中和FVIII。通过标准化添加的FVIII量和孵育时间,可以根据FVIII活性测定2测量的对照混合物的2。
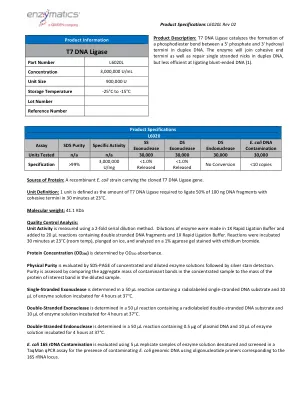
T7 DNA连接酶
蛋白质的来源:一种带有克隆的T7 DNA连接酶基因的重组大肠杆菌菌株。单位定义:1个单位定义为在30分钟内在23°C下在30分钟内将100 ng DNA片段的50%结合的T7 DNA连接酶的量。分子量:41.1 kDa质量控制分析:使用2倍连续稀释方法测量单位活动。稀释液,并添加到含有双链DNA片段和1倍快速连接缓冲液的20 µL反应中。在23°C(室温)下孵育30分钟,浸在冰上,并在用溴化乙锭染色的1%琼脂糖凝胶上进行分析。蛋白浓度(OD 280)由OD 280吸光度确定。物理纯度,然后进行银色染色检测。通过比较浓缩样品中污染物带的聚集质量与稀释样品中蛋白蛋白蛋白带的质量来评估纯度。单链核酸酶在含有放射性标记的单链DNA底物的50 µL反应中确定,在37°C下孵育4小时4小时。双链外切核酸酶在50 µL反应中确定,该反应含有放射性标记的双链DNA底物和10 µL的酶溶液在37°C下孵育4小时。双链核酸内切酶在50 µL反应中确定,该反应含有0.5 µg质粒DNA和10 µL的酶溶液在37°C下孵育4小时。大肠杆菌16S rDNA的污染是使用5 µL r菌酸溶液的样品变性的样品,并在Taqman QPCR分析中筛选,以使用与16S rRNA locus相应的寡核苷酸引物,使用污染的大肠杆菌Genomic DNA。
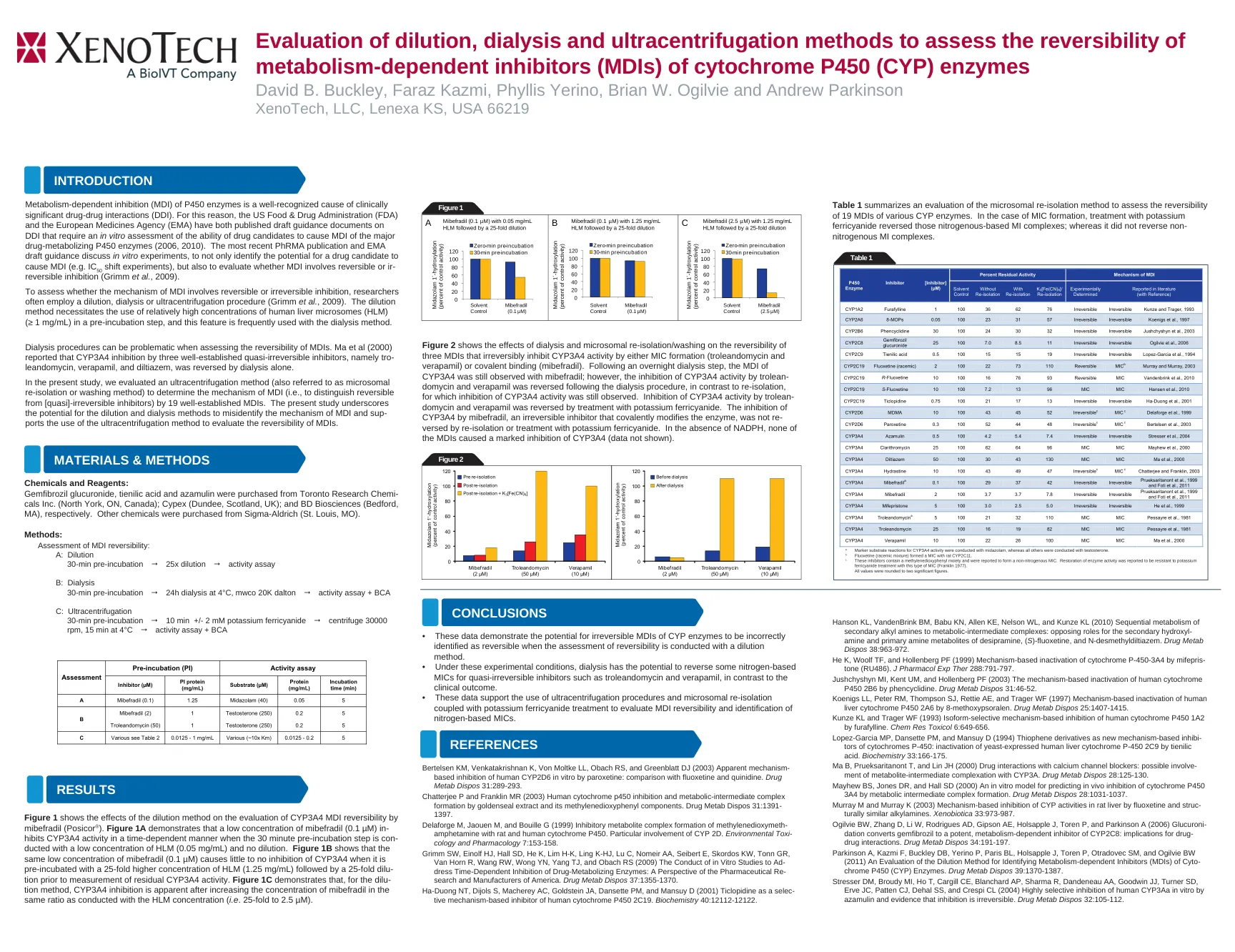
评估稀释,透析和超离心方法,以评估细胞色素P
图1显示了稀释方法对Mibefradil(Posicor®)评估CYP3A4 MDI可逆性的影响。图1A表明,当30分钟的预孵育步骤与低浓度的HLM(0.05 mg/ml)连接时,低浓度的Mibefradil(0.1 µM)In- in-biN-In-biN-In-inbiTs CYP3A4活性以时间依赖性方式且无稀释。图1b显示,当与HLM(1.25 mg/ml)的25倍高25倍的HLM(1.25 mg/ml)预孵育时,Mibefradil(0.1 µM)几乎不会抑制CYP3A4,然后进行25倍稀释,然后在测量残余CYP3A44444的稀释之前。图1c表明,对于稀释方法,CYP3A4抑制在增加Mibefradil的浓度以与HLM浓度相同的比例(即。25倍至2.5 µm)。