XiaoMi-AI文件搜索系统
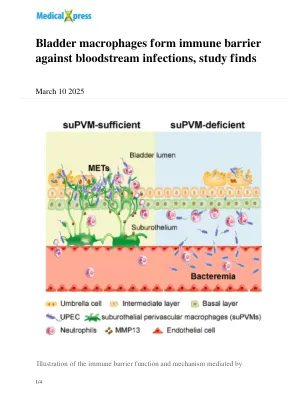
World File Search System膀胱巨噬细胞形成针对血液感染的免疫屏障,研究发现
这项研究通过揭示膀胱 - 叶片免疫屏障的存在和功能机制来扩展尿路中粘膜免疫的传统理解。这些发现解释了为什么UTI主要发生在膀胱中,而Urosepsis主要与肾脏感染有关。此外,这项研究提供了巨噬细胞症的第一个体内证据和Mets的形成,为探索组织驻留巨噬细胞的功能作用和命运开辟了新的途径。
trem2hi居民巨噬细胞通过保持心肌稳态来保护化粪池心脏
败血症诱导的心肌病(SICM)在高死亡率高的化粪池患者中很常见,其特征是免疫反应异常。由于细胞异质性,了解免疫细胞亚群在SICM中的作用一直具有挑战性。在这里,我们确定了称为CD163 + retnla +(Mac1)的心脏居民巨噬细胞的独特亚群,该巨噬细胞在败血症期间经历自我更新,可以针对以防止SICM。通过将单细胞RNA测序与败血症小鼠模型中的命运映射相结合,我们证明了MAC1亚群具有富含内吞作用的独特转录组特征,并显示了TREM2的高表达(TREM2 HI)。TREM2 HI MAC1细胞积极清除心肌细胞功能障碍线粒体。TREM2巨噬细胞中的缺乏症会损害MAC1亚群的自我更新能力,从而导致消除有缺陷的线粒体受损,心脏组织中的炎症过度反应,加剧心脏功能障碍和生存率降低。值得注意的是,脑内施用TREM2 HI MAC1细胞可防止SICM。我们的发现表明,TREM2 HI MAC1细胞的调节可以作为SICM的治疗策略。
免疫检查点抑制剂心肌炎中致病性心脏巨噬细胞的扩展
心脏成像在先天性心脏病(CHD)的诊断,治疗和监测中起关键作用。最先进的多模式成像技术的引入和传播可以在理解复杂CHD中的结构和功能中发挥作用。此外,高级成像可以使外科手术和基于导管的干预措施可提高围围骨性外部计划,并改善患者的预后。尽管医学成像的改进具有数十年的利用基于规则的算法,但添加人工智能(AI)算法(即可以从培训数据中学习模式的算法)可以提高处理复杂成像数据的速度和灵活性。使用AI的使用已在成像方式和成像管道的所有阶段都增长,包括患者选择和协议,图像采集,信号deoinging,图像注册和渲染,定量和解释(中心插图)。1
TCS/23/19-MAC-ENDO:对巨噬细胞靶向免疫疗法的概念验证和可行性研究
TCS/23/19-MAC-ENDO:对子宫内膜异位症治疗中巨噬细胞的免疫疗法的概念验证和可行性研究 - 相关的疼痛背景:子宫内膜异位症是一种影响10%的女性和出生时分配的女性的疾病。这是一种与子宫内衬里的细胞相似的条件(“病变”),并且会导致衰弱的骨盆疼痛。子宫内膜异位症可以通过荷尔蒙药物治疗,但只有三分之一的女性觉得这是有效的,并且经历了许多副作用。在子宫内膜异位中,免疫细胞称为巨噬细胞,被修饰并鼓励病变生长。目的:在子宫内膜异位症患者中,我们旨在研究(1)RRX-001的安全性和副作用,RRX-001是一种免疫治疗,旨在改变癌症的巨噬细胞; (2)未来在英国范围内进行大规模试验的可行性,以确定RRX-001是否可以减轻子宫内膜异位症相关的疼痛。设计和方法:我们计划进行一项名为Mac-endo的研究,其中36位患有子宫内膜异位疼痛的女性,随机分配为每周一次的RRX-001或相同的安慰剂,持续了六个星期。参与者将填写有关其症状的问卷调查,提供血液样本,并采集样本。从问卷调查中得出的信息以及对血液和子宫衬样品的分析将有助于我们计划未来的大型研究,以确定RRX-001是否减轻了子宫内膜异位症的疼痛。我们将采访20名女性,以了解她们对审判各个方面的感受,观点和想法。该试验结果还将在子宫内膜异位症网站和社交媒体上提供给患者。传播:试验结果将在医学期刊上发表,在医学会议上发表,并在社交媒体平台上的摘要/信息图表中公开。
巨噬细胞在糖尿病心肌病发病机理中的作用和治疗潜力
本综述对巨噬细胞及其基本机制在糖尿病心肌病(DCM)进展中所起的关键作用进行了全面分析。它首先讨论巨噬细胞的起源和多种亚型,阐明了它们的空间分布和细胞间通信的模式,从而强调了它们在DCM发病机理中的显着性。审查然后深入研究了巨噬细胞与DCM发作之间的复杂关系,尤其是侧重于在DCM条件下巨噬细胞采用的表观遗传调节机制。此外,审查还讨论了旨在针对巨噬细胞管理DCM的各种治疗策略。特别强调了天然食品成分在减轻糖尿病微血管并发症中的潜力,并检查了现有降血糖药物对巨噬细胞活性的调节作用。这些发现,总结在这篇综述中,不仅提供了巨噬细胞在糖尿病微血管并发症中的作用的新见解,而且还为未来的治疗研究和该领域的干预提供了宝贵的指导。
肿瘤巨噬细胞功能异质性可以告知新型癌症疗法的发展
巨噬细胞代表了肿瘤微环境(TME)的关键组成部分,并且主要与预后不良有关。宏观靶向的治疗靶向历史上一直集中在抑制其募集或重编程其表型从病(类似于M2)到抗肿瘤(M1类)。不幸的是,这种方法尚未提供改变实践的临床突破。利用单细胞RNA测序(SCRNA-SEQ)和空间转录组学的新兴研究提高了我们对巨噬细胞的本体发育,表型和功能可塑性的理解。覆盖有关巨噬细胞分子亚型和功能的当前信息的财富,还鉴定出了新型的治疗脆弱性,这些脆弱性可能可以更好地控制肿瘤相关的巨噬细胞(TAMS)。在这里,我们讨论了巨噬细胞的功能性培养,并提供了新型巨噬细胞靶向疗法的更新。
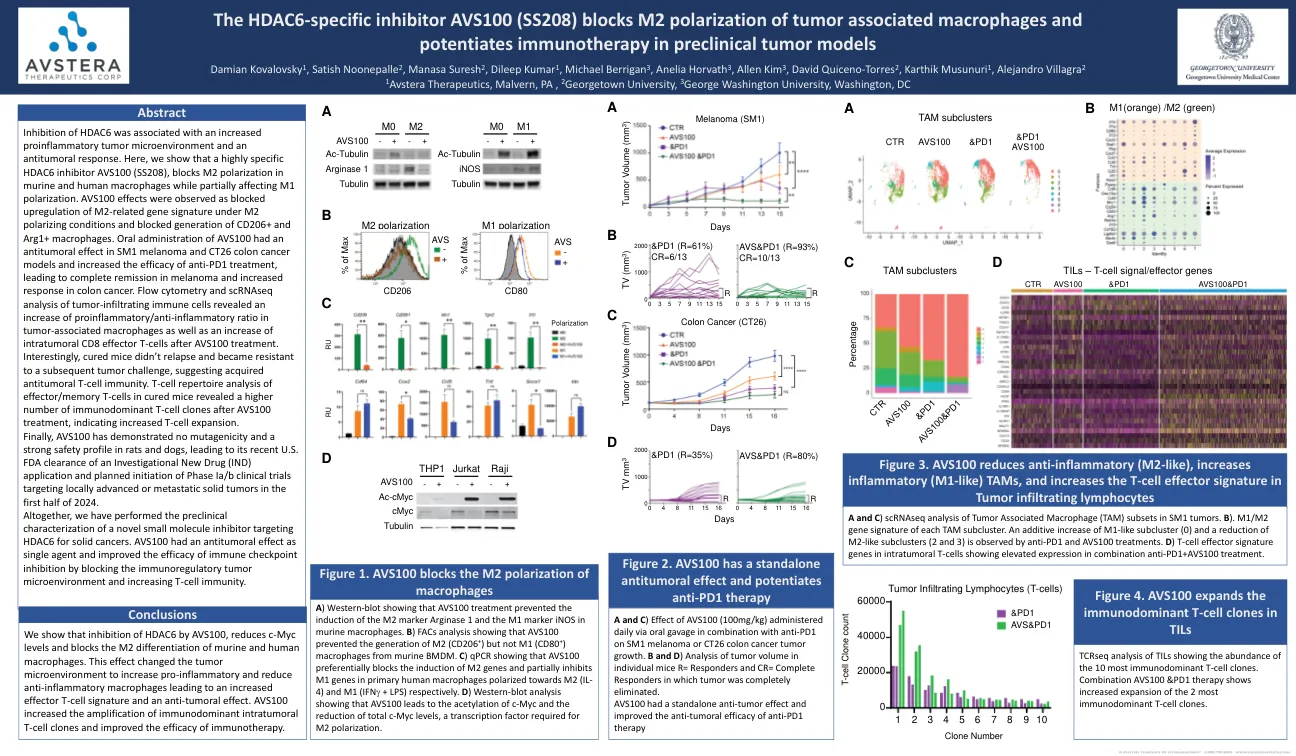
HDAC6特异性抑制剂AVS100(SS208)阻止了与肿瘤相关巨噬细胞的极化和
抑制HDAC6与促炎性肿瘤微环境和抗肿瘤反应的增加有关。 在这里,我们表明高度特异性的HDAC6抑制剂AVS100(SS208)阻止了鼠和人类巨噬细胞中的M2极化,同时部分影响M1极化。 AVS100效应被观察到在M2极化条件下与M2相关基因特征的上调,CD206+和ARG1+巨噬细胞的产生阻塞。 口服AVS100在SM1黑色素瘤和CT26结肠癌模型中具有抗肿瘤作用,并提高了抗PD1治疗的疗效,从而导致黑色素瘤完全缓解并增加了结肠癌的反应。 肿瘤浸润免疫细胞的流式细胞仪和SCRNASEQ分析显示,肿瘤相关巨噬细胞中促炎/抗炎的比率增加,以及在AVS100治疗后的肿瘤内CD8效应T细胞的增加。 有趣的是,固化的小鼠没有复发,并且对随后的肿瘤挑战有抵抗力,这表明获得了抗肿瘤的T细胞免疫。 T细胞曲目分析效果因子/记忆T细胞在AVS100治疗后显示出较高数量的免疫主导T细胞克隆,表明T细胞扩张的增加。 最后,AVS100在大鼠和狗中没有表现出没有诱变性和强大的安全性,从而导致其最近的美国FDA清除了针对IA/B期临床试验的研究新药(IND)施用,旨在针对2024年上半年的本地高级或转移实体瘤的临床试验。抑制HDAC6与促炎性肿瘤微环境和抗肿瘤反应的增加有关。在这里,我们表明高度特异性的HDAC6抑制剂AVS100(SS208)阻止了鼠和人类巨噬细胞中的M2极化,同时部分影响M1极化。AVS100效应被观察到在M2极化条件下与M2相关基因特征的上调,CD206+和ARG1+巨噬细胞的产生阻塞。口服AVS100在SM1黑色素瘤和CT26结肠癌模型中具有抗肿瘤作用,并提高了抗PD1治疗的疗效,从而导致黑色素瘤完全缓解并增加了结肠癌的反应。 肿瘤浸润免疫细胞的流式细胞仪和SCRNASEQ分析显示,肿瘤相关巨噬细胞中促炎/抗炎的比率增加,以及在AVS100治疗后的肿瘤内CD8效应T细胞的增加。 有趣的是,固化的小鼠没有复发,并且对随后的肿瘤挑战有抵抗力,这表明获得了抗肿瘤的T细胞免疫。 T细胞曲目分析效果因子/记忆T细胞在AVS100治疗后显示出较高数量的免疫主导T细胞克隆,表明T细胞扩张的增加。 最后,AVS100在大鼠和狗中没有表现出没有诱变性和强大的安全性,从而导致其最近的美国FDA清除了针对IA/B期临床试验的研究新药(IND)施用,旨在针对2024年上半年的本地高级或转移实体瘤的临床试验。口服AVS100在SM1黑色素瘤和CT26结肠癌模型中具有抗肿瘤作用,并提高了抗PD1治疗的疗效,从而导致黑色素瘤完全缓解并增加了结肠癌的反应。肿瘤浸润免疫细胞的流式细胞仪和SCRNASEQ分析显示,肿瘤相关巨噬细胞中促炎/抗炎的比率增加,以及在AVS100治疗后的肿瘤内CD8效应T细胞的增加。有趣的是,固化的小鼠没有复发,并且对随后的肿瘤挑战有抵抗力,这表明获得了抗肿瘤的T细胞免疫。T细胞曲目分析效果因子/记忆T细胞在AVS100治疗后显示出较高数量的免疫主导T细胞克隆,表明T细胞扩张的增加。最后,AVS100在大鼠和狗中没有表现出没有诱变性和强大的安全性,从而导致其最近的美国FDA清除了针对IA/B期临床试验的研究新药(IND)施用,旨在针对2024年上半年的本地高级或转移实体瘤的临床试验。总的来说,我们对固体癌的靶向HDAC6的新型小分子抑制剂进行了临床前表征。AVS100作为单一药物具有抗肿瘤作用,并通过阻止免疫调节性肿瘤微环境和增加T细胞免疫力来提高免疫检查点抑制的功效。
使用流体壁微流体技术检测巨噬细胞趋化性
自 1960 年代以来,人们使用了各种趋化性测定方法,但这些测定方法都存在很大的局限性。Transwell 测定方法技术简单且应用广泛;将装有细胞的多孔插入物放置在装有引诱剂的孔内,(一旦通过扩散建立起浓度梯度)细胞就会通过微米大小的孔迁移到孔中,通过取出插入物并计数孔中的细胞来量化趋化性。[5] xCEL-Ligence 测定方法提供了一项重大技术进步;当细胞穿过改良的 Boyden 室中的孔时,可以实时测量阻抗变化。[6] 为了解决 Transwell 测定方法的一些局限性,人们引入了替代方法,包括跟踪和监测单个细胞(如 Dunn 室)[7] 以及检测细胞可逆性或细胞趋向性(如琼脂糖下迁移测定方法)。 [8] 最近,人们开发出了微流控系统 [9],该系统能够控制稳定的梯度,[10] 区分不同类型的运动(例如,趋化性、化学运动——无方向性细胞迁移和逃逸性 [11] ),实时追踪单个细胞,[12] 并提高吞吐量 [13]——有时不需要太多依赖专门的设备即可实现。 [14] 虽然微流控方法前景广阔,但它们在生物医学研究中的应用受到了阻碍,因为操作设备所需的技术复杂性、制造和原型制作时间长、经常使用的塑料的生物相容性问题(即聚二甲基硅氧烷、
鼻咽癌中的 FGF-2 信号调节周细胞-巨噬细胞串扰和转移
引言鼻咽癌(NPC)在2018年造成73,000人死亡,东南亚的发病率最高(1,2)。鼻咽癌发展的常见因素包括爱泼斯坦-巴尔病毒(EBV)感染、遗传易感性和生活方式(2)。临床上,放疗和化疗是推荐用于早期鼻咽癌和非转移性鼻咽癌患者(3)。然而,转移性鼻咽癌患者的治疗选择有限。转移性鼻咽癌似乎是一类异质性肿瘤,生存范围广泛,肺、肝和骨是远处转移最常见的部位(4)。靶向治疗被公认为进一步延长鼻咽癌患者生存的有效方法。然而,多项临床试验表明,与常规放化疗相比,针对血管内皮生长因子 (VEGF) 信号的贝伐单抗或针对表皮生长因子 (EGF) 信号的西妥昔单抗在鼻咽癌患者中未显示出临床益处 (5–7)。因此,迫切需要开发针对鼻咽癌的新型分子靶向治疗。鼻咽癌转移机制研究是开发新型靶向治疗的基础。目前,鼻咽癌转移研究主要集中在
巨噬细胞的细胞外囊泡作为慢性非传染病的新玩家
巨噬细胞是所有组织中存在的先天免疫细胞,并且在生物生物的生物学几乎所有方面都起着重要作用。细胞外囊泡(EV)由细胞释放,并将其含量(微RNA,mRNA,蛋白质和长期非编码RNA)运输到附近或远处的细胞中,以进行细胞间通信。许多研究表明,巨噬细胞衍生的细胞外囊泡(M-EV)及其含量在多种疾病中起着重要作用,并且作为生物标志物,治疗剂和药物输送措施的巨大潜力。本文回顾了M-EV的生物学功能和机制及其在慢性非传染性疾病中的含量,例如心血管疾病,代谢性疾病,癌症,炎症性疾病和骨相关疾病。此外,总结了M-EV作为各种疾病的药物输送系统的潜在应用。