XiaoMi-AI文件搜索系统
World File Search System研究论文基于基因组规模的 CRISPR-Cas9 敲除筛选促进退出幼稚多能性的基因
干细胞和再生医学面临的两个主要问题是多能性的退出和向功能性细胞或组织的分化。这两个问题的答案对于干细胞和再生医学研究的临床转化具有重要意义。尽管越来越多的研究揭示了多能性维持的真相,但多能细胞自我更新、增殖和向特定细胞谱系或组织分化的机制尚不清楚。为此,我们充分利用了一项新技术,即基因组规模的 CRISPR-Cas9 敲除 (GeCKO)。作为一种在基因组特定位点引入靶向功能丧失突变的有效方法,GeCKO 能够首次以无偏向的方式筛选促进小鼠胚胎干细胞 (mESC) 退出多能性的关键基因。本研究成功建立了基于GeCKO的模型,用于筛选多能性退出的关键基因。我们的策略包括慢病毒包装感染技术、lenti-Cas9基因敲除技术、shRNA基因敲除技术、二代测序、基于模型的基因组规模CRISPR-Cas9敲除分析(MAGeCK分析)、GO分析等方法。我们的研究结果为大规模筛选多能性退出基因提供了一种新方法,为细胞命运调控研究提供了一个切入点。
原创研究基因编辑和RNA结合蛋白IGF2BP2/IMP2的小分子抑制剂展现出作为抗癌药物靶点的潜力
背景:RNA 结合蛋白 IGF2BP2/IMP2/VICKZ2/p62 是一种癌胚蛋白,在几种癌症实体中过表达。利用 IMP2 敲除的结肠直肠癌细胞,我们可以展示 IMP2 在几种癌症特征中的重要作用。本研究旨在从功能上表征肺癌(A549、LLC1)和肝细胞癌(HepG2、Huh7)细胞系中的 IMP2,以评估其作为这些癌症实体的潜在靶点的作用。方法:通过 CRISPR/Cas9 及其变体方法主要编辑产生 IMP2 敲除;通过下一代测序验证两种单向导 RNA(sgRNA)的编辑效率。我们研究了 IMP2 敲除对细胞增殖、菌落形成和迁移的影响,并采用了 IMP2 的小分子抑制剂。结果:尽管多次尝试,但无法在 A549 和 Huh7 细胞中产生 IMP2 双等位基因敲除。两种 sgRNA 均表现出良好的编辑效率。然而,编辑后的细胞失去了增殖能力。使用 CRISPR/Cas9 在 LLC1 细胞中生成 IMP2 双等位基因敲除的尝试取得了成功。IMP2 的单等位基因敲除细胞系显示 2D 细胞增殖减少和迁移减少。在 3D 培养中,观察到形态从紧凑的球体变为松散的聚集体,并且 IMP2 敲除的集落形成能力明显降低,这种效果与先前发现的 IMP2 抑制剂化合物相似,也显示出对集落形成的抑制作用。结论:我们的体外靶标验证支持 IMP2 对几种癌症实体中的肿瘤细胞增殖、迁移和集落形成至关重要。
原文 通过 CRISPR/Cas9 消除 CNE2 鼻咽细胞中的 microRNA-21 可抑制增殖并通过靶向 PI3K/A 诱导细胞凋亡
摘要:背景:探讨CRISPR/Cas9介导的microRNA 21(miR-21)敲除对鼻咽癌CNE2细胞生物学特性的影响及可能的作用机制。方法:设计针对miR-21基因的sgRNA,构建CRISPR/Cas9慢病毒系统并通过T7EN1酶切检测编辑效率。通过CCK-8、Transwell侵袭实验和流式细胞术检测miR-21敲除对CNE2细胞生物学特性的影响。通过生物信息学分析和免疫印迹研究其作用机制。结果:获得了靶向敲低miR-21基因的CRISPR/Cas9系统,miR-21敲除明显抑制CNE2细胞的生长、克隆形成、侵袭和迁移能力,从而诱导细胞凋亡。生物信息学分析共鉴定出28个KEGG。进一步的免疫印迹分析显示,miR-21敲除后,PI3K/AKT/mTOR信号通路相关蛋白的表达降低。结论:miR-21敲除可抑制CNE2细胞的生长增殖并诱导其凋亡,其机制可能与抑制PI3K/AKT/mTOR信号通路有关。
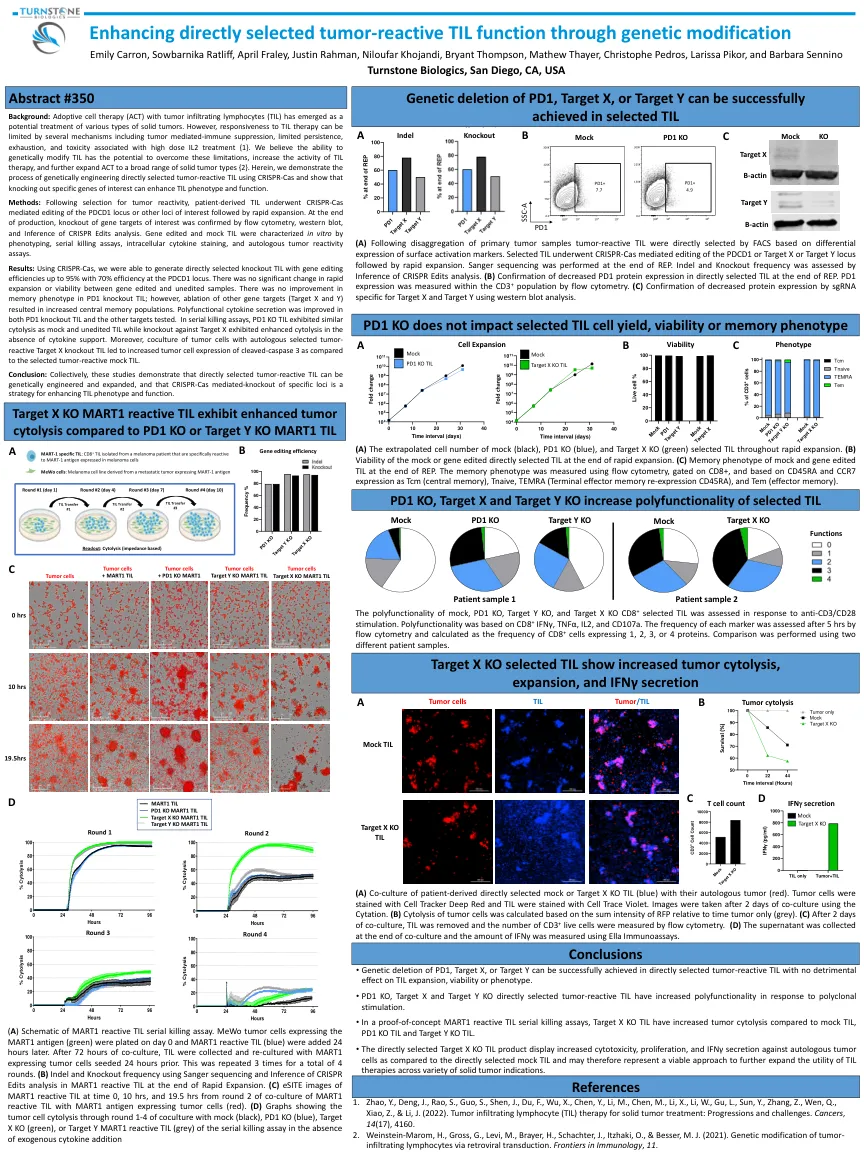
通过基因改造增强直接选择的肿瘤反应性 TIL 功能
结果:使用 CRISPR-Cas,我们能够生成直接选择的敲除 TIL,其基因编辑效率高达 95%,PDCD1 基因位点的效率为 70%。基因编辑和未编辑样本之间的快速扩增或活力没有显著变化。PD1 敲除 TIL 的记忆表型没有改善;然而,其他基因靶标(靶标 X 和 Y)的消融导致中枢记忆群体增加。PD1 敲除 TIL 和测试的其他靶标中的多功能细胞因子分泌均得到改善。在连续杀伤试验中,PD1 KO TIL 表现出与模拟和未编辑 TIL 相似的细胞溶解,而靶标 X 的敲除在没有细胞因子支持的情况下表现出增强的细胞溶解。此外,与选定的肿瘤反应性模拟 TIL 相比,肿瘤细胞与自体选定的肿瘤反应性靶标 X 敲除 TIL 共培养导致肿瘤细胞裂解半胱天冬酶 3 的表达增加。
arXiv:2502.01012v1 [cs.LG] 2025 年 2 月 3 日
最近的技术进步引入了新的高通量方法来研究宿主-病毒相互作用,但在感染期间测试宿主基因对之间的协同相互作用仍然相对缓慢且劳动密集。识别有效抑制病毒复制的多基因敲除需要搜索所有可能的目标基因对的组合空间,而通过蛮力实验是行不通的。尽管用于顺序实验设计的主动学习方法已显示出良好的前景,但现有方法通常仅限于单基因敲除或小规模双基因敲除数据集。在本研究中,我们提出了一个集成的深度主动学习 (DeepAL) 框架,该框架结合了来自生物知识图谱 (SPOKE,可扩展精准医学开放知识引擎) 的信息,以有效地搜索 HIV 感染中 356 个人类基因的所有成对敲除的大型数据集的配置空间。通过图形表示学习,该框架能够生成特定于任务的基因表示,同时平衡探索-利用权衡,以精确定位高效的双基因敲除对。我们还提出了一种用于不确定性量化的集成方法,以及通过通路分析对我们的算法选择的基因对进行解释。据我们所知,这是第一项在规模可观的双基因敲除实验数据(356 x 356 矩阵)上显示出良好结果的研究。
基因组编辑技术基础知识产权...
使您能够编辑基因组中的任何位置图 1. 使用 TALXcell 平台敲除 T 细胞受体 (TCR)。使用 Invitrogen ™ Neon ™ 转染系统通过电穿孔将 TALXcell mRNA 递送至原代人类 T 细胞。使用藻红蛋白 (PE) 偶联的 TCR 抗体通过流式细胞术测量 TCR 敲除效率。TALXcell 平台实现了 94.9% 的 TCR 敲除效率,这与在类似实验中使用 CRISPR-Cas9 观察到的效率相似。
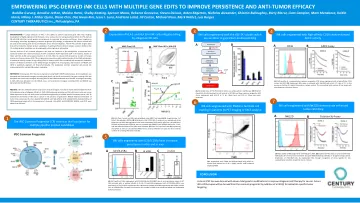
赋予IPSC衍生的墨水细胞具有多个基因编辑,以提高持久性和抗肿瘤功效
这种常见祖细胞库的关键特征是:敲除β2微球蛋白的敲除,以消除HLA-I表达(CD8 T细胞逃避); CIITA敲除消除HLA-II表达(CD4 T细胞逃避); HLA-E和HLA-G(NK细胞逃避)的敲击蛋白; IL-15/IL-15RA的敲击素以增强墨水持久性;单纯疱疹病毒酪氨酸激酶(HSV-TK)作为Ganciclovir响应性安全开关; psma胞外域的敲击蛋白可以使细胞追踪;高亲和力CD16的敲击蛋白与治疗性抗体结合时增强ADCC; NKG2D的敲击蛋白通过识别胁迫配体来增强肿瘤杀死; NKG2A和CD70的敲除可能增强细胞适应性/功能。工程的共同祖先将为多个墨水产品候选者提供起始材料。
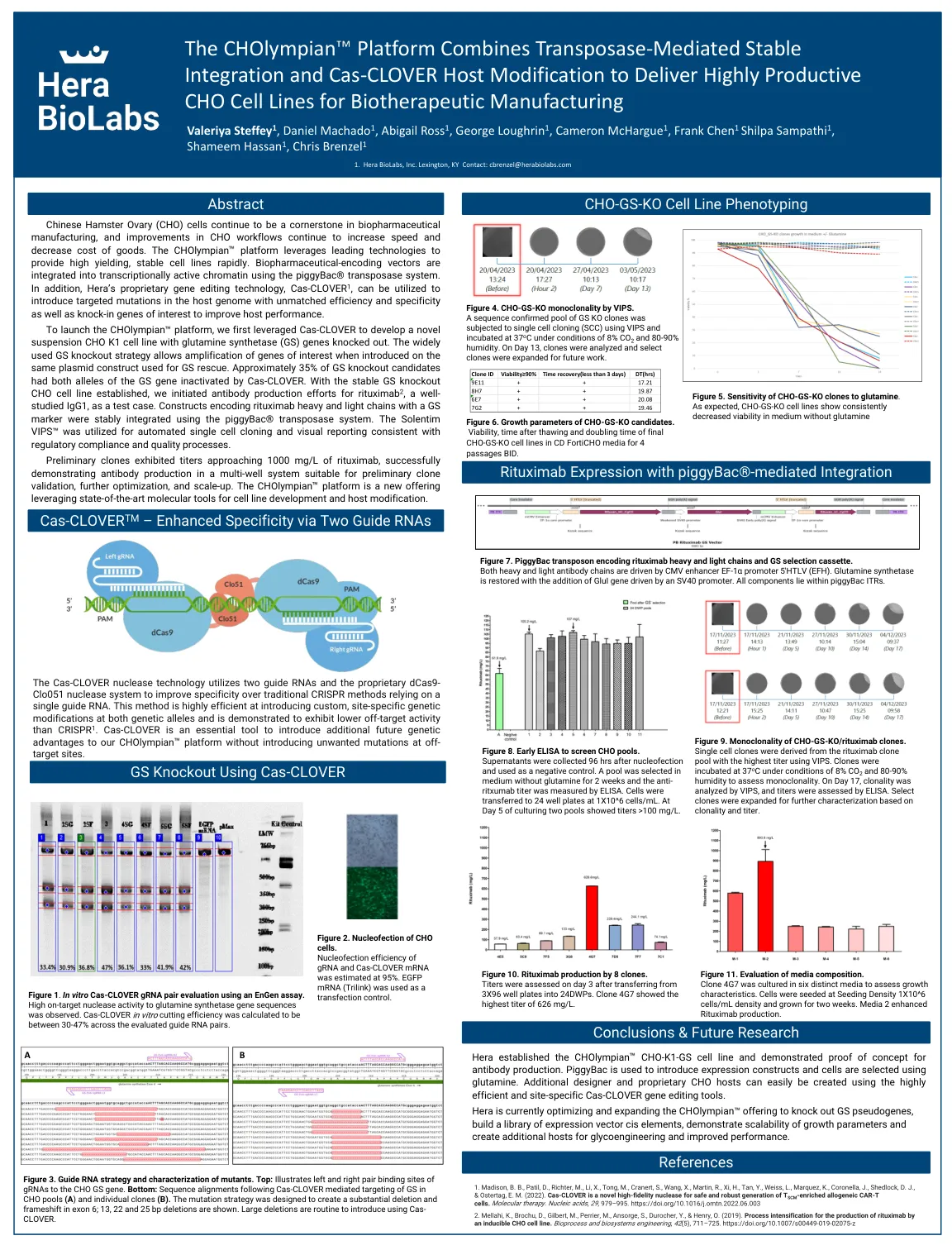
CHOlympian 平台结合转座酶...
平台,我们首先利用 Cas-CLOVER 开发了一种敲除谷氨酰胺合成酶 (GS) 基因的新型悬浮 CHO K1 细胞系。广泛使用的 GS 敲除策略允许在用于 GS 拯救的相同质粒构建体上引入目的基因时对其进行扩增。大约 35% 的 GS 敲除候选细胞的两个等位基因都被 Cas-CLOVER 灭活。在建立稳定的 GS 敲除 CHO 细胞系后,我们开始针对利妥昔单抗 2(一种研究充分的 IgG1)进行抗体生产,作为测试案例。使用 piggyBac® 转座酶系统稳定整合了编码具有 GS 标记的利妥昔单抗重链和轻链的构建体。Solentim VIPS
人原代T细胞基因组编辑
( A )使用ImmunoCult™ 人 CD3 / CD28 或 CD3 / CD28 / CD2 T 细胞激活活化剂人 T 2 - 3 天后,通过将 TCR αβ 和 CD3 受体与抗体结合,进行流式分析,来测定 TRAC 的敲除效率。每个条件的每个数据点代表一个单独的供体;n = 4 - 8 个供体。每一列线路表示干±标准差。( B ) )首先人T细胞被ImmunoCult™人CD3 / CD28 T细胞剂激活活化剂3天,然后进行电转。在电转48小时后,通过ArciTect™ T7循环内切酶I试剂盒测定基因组编辑(切割)的效率。 RNP 电转:+ RNP 。( C - D )被ImmunoCult™ 人 CD3 / CD28 T 细细胞激活剂活化 3 天的人 T 细胞经( C )模拟电转(无 RNP )和( D ) RNP 电转后 TCR αβ 和 CD3 的流式分析点图。( E )被ImmunoCult™ 人 CD3 / CD28 T 细胞激活剂活化 3 天的人 T细胞的CD4和CD8流式分析点图。
GeneTargeter:针对疟原虫恶性疟原虫进行基因组编辑的自动化计算机设计
摘要 对人类疟疾病原体恶性疟原虫中大量描述不详的蛋白质进行功能表征需要工具来实现基因组规模的扰动研究。在这里,我们介绍了 GeneTargeter (genetargeter.mit.edu),这是一种软件工具,用于自动设计同源定向修复供体载体,以实现恶性疟原虫基因的基因敲除、条件性敲除和表位标记。我们展示了 GeneTargeter 辅助的六种不同类型的恶性疟原虫基因组敲除和条件性敲除构建体的基因组规模设计,并通过成功的供体载体组装和转染实验验证了计算设计过程。该软件的模块化特性可容纳任意目标载体,并允许定制设计,以扩展在疟原虫和其他生物体中可获得的基因组操作结果。




![arXiv:2502.01012v1 [cs.LG] 2025 年 2 月 3 日](/simg/6\64c8887d233e4545c48c2c43afc145dcc5acc984.webp)