XiaoMi-AI文件搜索系统
World File Search System崩溃的肾小球病是青春期快速进行性肾衰竭的罕见原因:两个病例报告
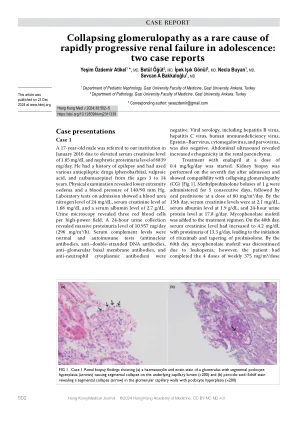
,由于血清肌酐水平升高为1.85 mg/dl,肾病蛋白尿水平为6839 mg/天,因此在2016年1月被转诊至我们的机构。他有癫痫病史,并使用了3至14岁的各种抗癫痫药(苯巴比妥,丙戊酸和卡马西平)。体格检查显示下肢水肿和血压为140/90 mm Hg。入院的实验室测试显示,血尿素氮水平为24 mg/dL,血清肌酐水平为1.68 mg/dl,血清白蛋白水平为2.7 g/dl。尿液显微镜显示每个高功率场三个红细胞。24小时的尿液集合显示大量蛋白尿水平为10.957 mg/天(296 mg/m 2/h)。血清补体水平是正常的,自身免疫性测试(抗核抗体,抗双链DNA抗体,抗粘膜基底膜抗体和抗独立粒细胞胞质抗体)是
醛固酮合酶抑制剂(BI 690517)治疗糖尿病患者和蛋白尿慢性肾脏疾病:多中心,随机,双盲,安慰剂对照,I期试验
1。Verma A,Vaidya A,Subudhi S,Waikar SS。醛固酮在慢性儿童疾病和肾脏结局中。EUR HEART j。 2022; 43(38):3781-3791。 2。 Garg V,Kumar M,Mahapatra HS,Chitkara A,Gadpayle AK,Sekhar V.糖尿病前肾病中的新型尿液生物标志物。 临床肾上腺素。 2015; 19(5):895-900。 3。 NAMSolleck P,Unger T.心脏和肾脏疾病中的醛固酮合酶抑制剂。 肾词表盘移植。 2014; 29(增刊1):I62-I68。 4。 Tuttle KR,Agarwal R,Alpers CE等。 分子机制和糖尿病肾脏疾病的治疗靶标。 肾脏Int。 2022; 102(2):248-260。 5。 Shrestha A,Che RC,Zhang Ah。 醛固酮在肾纤维化中的作用。 Adv Exp Med Biol。 2019; 1165:325-346。 6。 Rossing P,Caramori ML,Chan JCN等。 KDIGO 2022临床实践指南的执行摘要慢性肾脏疾病:基于迅速出现的新证据的更新。 肾脏Int。 2022; 102(5):990-999。 7。 Andersen K,Hartman D,Peppard T等。 醛固酮合酶抑制对高血压患者醛固酮和皮质醇的影响:II期,随机,双盲,安慰剂控制,多中心研究。 J临床高血压(格林威治)。 2012; 14(9):580-587。 8。 Hargovan M,Ferro A.醛固酮合酶抑制剂在高血压中:当前状态和未来的可能性。EUR HEART j。2022; 43(38):3781-3791。2。Garg V,Kumar M,Mahapatra HS,Chitkara A,Gadpayle AK,Sekhar V.糖尿病前肾病中的新型尿液生物标志物。临床肾上腺素。2015; 19(5):895-900。 3。 NAMSolleck P,Unger T.心脏和肾脏疾病中的醛固酮合酶抑制剂。 肾词表盘移植。 2014; 29(增刊1):I62-I68。 4。 Tuttle KR,Agarwal R,Alpers CE等。 分子机制和糖尿病肾脏疾病的治疗靶标。 肾脏Int。 2022; 102(2):248-260。 5。 Shrestha A,Che RC,Zhang Ah。 醛固酮在肾纤维化中的作用。 Adv Exp Med Biol。 2019; 1165:325-346。 6。 Rossing P,Caramori ML,Chan JCN等。 KDIGO 2022临床实践指南的执行摘要慢性肾脏疾病:基于迅速出现的新证据的更新。 肾脏Int。 2022; 102(5):990-999。 7。 Andersen K,Hartman D,Peppard T等。 醛固酮合酶抑制对高血压患者醛固酮和皮质醇的影响:II期,随机,双盲,安慰剂控制,多中心研究。 J临床高血压(格林威治)。 2012; 14(9):580-587。 8。 Hargovan M,Ferro A.醛固酮合酶抑制剂在高血压中:当前状态和未来的可能性。2015; 19(5):895-900。3。NAMSolleck P,Unger T.心脏和肾脏疾病中的醛固酮合酶抑制剂。肾词表盘移植。2014; 29(增刊1):I62-I68。 4。 Tuttle KR,Agarwal R,Alpers CE等。 分子机制和糖尿病肾脏疾病的治疗靶标。 肾脏Int。 2022; 102(2):248-260。 5。 Shrestha A,Che RC,Zhang Ah。 醛固酮在肾纤维化中的作用。 Adv Exp Med Biol。 2019; 1165:325-346。 6。 Rossing P,Caramori ML,Chan JCN等。 KDIGO 2022临床实践指南的执行摘要慢性肾脏疾病:基于迅速出现的新证据的更新。 肾脏Int。 2022; 102(5):990-999。 7。 Andersen K,Hartman D,Peppard T等。 醛固酮合酶抑制对高血压患者醛固酮和皮质醇的影响:II期,随机,双盲,安慰剂控制,多中心研究。 J临床高血压(格林威治)。 2012; 14(9):580-587。 8。 Hargovan M,Ferro A.醛固酮合酶抑制剂在高血压中:当前状态和未来的可能性。2014; 29(增刊1):I62-I68。4。Tuttle KR,Agarwal R,Alpers CE等。分子机制和糖尿病肾脏疾病的治疗靶标。肾脏Int。 2022; 102(2):248-260。 5。 Shrestha A,Che RC,Zhang Ah。 醛固酮在肾纤维化中的作用。 Adv Exp Med Biol。 2019; 1165:325-346。 6。 Rossing P,Caramori ML,Chan JCN等。 KDIGO 2022临床实践指南的执行摘要慢性肾脏疾病:基于迅速出现的新证据的更新。 肾脏Int。 2022; 102(5):990-999。 7。 Andersen K,Hartman D,Peppard T等。 醛固酮合酶抑制对高血压患者醛固酮和皮质醇的影响:II期,随机,双盲,安慰剂控制,多中心研究。 J临床高血压(格林威治)。 2012; 14(9):580-587。 8。 Hargovan M,Ferro A.醛固酮合酶抑制剂在高血压中:当前状态和未来的可能性。肾脏Int。2022; 102(2):248-260。5。Shrestha A,Che RC,Zhang Ah。醛固酮在肾纤维化中的作用。Adv Exp Med Biol。2019; 1165:325-346。 6。 Rossing P,Caramori ML,Chan JCN等。 KDIGO 2022临床实践指南的执行摘要慢性肾脏疾病:基于迅速出现的新证据的更新。 肾脏Int。 2022; 102(5):990-999。 7。 Andersen K,Hartman D,Peppard T等。 醛固酮合酶抑制对高血压患者醛固酮和皮质醇的影响:II期,随机,双盲,安慰剂控制,多中心研究。 J临床高血压(格林威治)。 2012; 14(9):580-587。 8。 Hargovan M,Ferro A.醛固酮合酶抑制剂在高血压中:当前状态和未来的可能性。2019; 1165:325-346。6。Rossing P,Caramori ML,Chan JCN等。KDIGO 2022临床实践指南的执行摘要慢性肾脏疾病:基于迅速出现的新证据的更新。肾脏Int。 2022; 102(5):990-999。 7。 Andersen K,Hartman D,Peppard T等。 醛固酮合酶抑制对高血压患者醛固酮和皮质醇的影响:II期,随机,双盲,安慰剂控制,多中心研究。 J临床高血压(格林威治)。 2012; 14(9):580-587。 8。 Hargovan M,Ferro A.醛固酮合酶抑制剂在高血压中:当前状态和未来的可能性。肾脏Int。2022; 102(5):990-999。7。Andersen K,Hartman D,Peppard T等。 醛固酮合酶抑制对高血压患者醛固酮和皮质醇的影响:II期,随机,双盲,安慰剂控制,多中心研究。 J临床高血压(格林威治)。 2012; 14(9):580-587。 8。 Hargovan M,Ferro A.醛固酮合酶抑制剂在高血压中:当前状态和未来的可能性。Andersen K,Hartman D,Peppard T等。醛固酮合酶抑制对高血压患者醛固酮和皮质醇的影响:II期,随机,双盲,安慰剂控制,多中心研究。J临床高血压(格林威治)。2012; 14(9):580-587。8。Hargovan M,Ferro A.醛固酮合酶抑制剂在高血压中:当前状态和未来的可能性。JRSM心脏脉络。2014; 3:2048004014522440。9。lu Y,Ku E,Campese VM。醛固酮在慢性肾脏疾病和蛋白尿的发病机理中。Curr Hypertens Rep。2010; 12(4):303-306。2010; 12(4):303-306。
肠道轴在坏死性小肠结肠炎的神经发育障碍中的作用
过去,由于糖尿病造成的肾功能障碍主要是蛋白尿之前首先发生的疾病,然后随后降低了EGFR(1,2)。最近,已经观察到没有明显蛋白尿的肾小球效果率(GFR)降低。因此,糖尿病肾病的概念已被认为是糖尿病性肾病的伞概念(1,2)。近年来,已经报道了SGLT2抑制剂和GLP-1受体激动剂的肾脏预后改善,并且在临床实践中实际上感觉到这些药物的作用(3),但DKD的发病机理仍然很大程度上仍然没有探索。最近,近端肾小管细胞在糖尿病肾脏病发病机理中的作用一直是研究的重点(4)。糖尿病性肾小球肾病主要是肾小球损伤。相比之下,糖尿病肾脏疾病不仅涉及肾肾小球肾病,而且还涉及肾小球纤维化。基于肾脏活检样本的解剖区域,糖尿病肾脏疾病可以分为肾小球糖尿病肾脏疾病和管状糖尿病性肾脏疾病。肾小球糖尿病肾病的共同特征涉及受损的肾小球滤过屏障,肾小球细胞增殖和肾小球骨膜硬化。管状糖尿病性肾脏疾病的主要表现包括肾小管重吸收和分泌的功能障碍以及肾小管纤维化(4)。此外,近端管状损伤在患有/没有蛋白尿的糖尿病肾脏疾病的进展中具有重要作用(2,4)。糖尿病肾脏疾病中肾小球和微管间质损伤的机制不同,但是相关途径和介体的相互作用很多。因此,在此卷中,一些论文集中在肾小管上皮细胞上。纤毛是一种基于微管的细胞器,它是从大多数脊椎动物细胞类型的表面投射,并检测和传输细胞外信号(5)。睫状生命周期也与细胞周期密切相关。肾纤毛是
人类数字双胞胎(HDT)驱动的人类周期系统:关键技术和应用氮化硅离子敏感场效应晶体管
营养不良,肝病,肾病,休克,水肿和心血管疾病。相比之下,可以在脱水中发现高水平的白蛋白(高蛋白血症,> 55 g/L),体重或体内脂肪的增加。3在健康人的尿液中排泄少量白蛋白,尿液中白蛋白的参考范围为2.2-25 mg/l。4,5但是,当由于糖尿病或肾脏损伤而变得更可渗透时,可能会发生升高的尿白蛋白排泄。1,6严重的肾小球滤过机制可以增加以增加尿白蛋白排泄,该尿白蛋白排泄称为微藻或大藻蛋白尿,具体取决于丢失的白蛋白量。5,6微量白蛋白尿是指从24小时的尿液中收集24 h尿液或30-300 mg/l的尿白蛋白排泄,从随机或先生的尿液收集中。4这种白蛋白显示出最早的糖尿病性肾病阶段。然而,在没有早期检测和治疗的患者中,微量白蛋白尿可能会在一年中的一年中发展到不可逆的大藻(4300 mg/day)。因此,在非糖尿病患者中有慢性肾脏疾病和心血管疾病的人的肾脏损害的早期迹象。6已提出许多方法来确定尿液中的白蛋白量,例如酶联免疫吸附测定法(ELISA),7种荧光,8,9 Immunotortytimetry(IT),10,111111111111 IN)免疫法(IN),12个padimimmunoas- Say(RIA),RIA),13和CHEMIA,13和CHEMIA(CLIA),13和CHEMIA(CLIA)。14,15尽管这些方法是高灵敏度和特异性,但它们存在一些局限性,例如健康危害,耗时,劳动力密集的协议以及需要经验丰富的技术人员。因此,已经开发了几种传感器方法作为一种简单的方法来确定HSA的量,例如石英晶体微生体(QCM),16,17电化学传感器,18-20
糖尿病和糖尿病肾病
糖尿病(DM)是一种代谢系统性疾病,发病率和死亡率高。在2008年柳叶刀(Lancet)的编辑文章中,由于2型DM(T2DM)和妊娠DM病例的百分比增加,糖尿病的全球挑战是21世纪最大的流行病,以及T2DM的年轻患者的数量(年轻人成熟 - 糖糖尿病的年轻人,年轻人,MODY,MODY)[1]。DM的疾病负担预计将在未来几年和几十年内增加。国际DM联合会的地图集[2]估计,2022年有5.37亿成年人(20-79岁)的DM生活,到2030年,这一数字可能会增加到6.43亿,到2045年。在低收入和中等收入国家,有近75%的DM成年人生活。dm估计在2021年造成了670万人死亡,导致至少9660亿美元的成本,在过去15年中增长了316%。500万成年人患有葡萄糖耐受性受损的成年人的T2DM风险增加。有超过100万儿童患有1型DM [2]。与IDF数据并行,与DM有关的出版物数量不断增加。截至2023年4月3日,有419,974个相关出版物。有59,185个提及DM心血管(CV)并发症,糖尿病性肾病(DN)为34,299,糖尿病肾病(DKD)有33,414。DKD仍然是全球终末期肾脏疾病(ESRD)的主要原因。DN的定义和流行病学已经实质性发展。2011年,Tervaert等。在过去的15年中,与DM相关并发症,急性心肌梗死,中风和截肢的年龄标准化率有所下降,但尚未降低晚期慢性肾脏病(CKD)需要肾脏替代疗法(RRT)的发生率。经典演示包括蛋白尿和随后的蛋白尿的逐步增长[3]。然而,越来越多地描述了估计的肾小球效果率(EGFR)的DM和CKD患者的非蛋白尿表型[4]。指出,DN的经典定义包括肾小球病变,但DKD的更广泛概念考虑了包括肾小管间隙和/或血管病变在内的DM患者的肾脏参与[5]。与蛋白尿或EGFR不同的新型仪器(例如尿蛋白质组学)对于更好地发现基线EGFR高于60 mL/min/min/1.73 m 2的个体的DKD是必要的。四十年前,DM参加肾脏病门诊诊所的患者通常出现晚期CKD,严重的CV并发症,晚期视网膜病或Amauro-sis或下肢截肢。但是,在获得肾脏病护理之前,DM患者经常因尿毒症或简历并发症而死亡。多学科和多学科护理已极大地改变了这种古老的灾难性疾病的全景。用于管理DM和CKD患者的综合方法的支柱是基于五类药物的:
CGAS刺道途径不会促进SLE> sle>的鼠模型中的自身免疫性
检测DNA是宿主防御的重要决定因素,也是自动弹性和自身免疫性疾病的驱动因素。未能在dnaseii或iii(trex1)中降解自DNA,从而导致CGAS刺激途径的激活。表达可改善疾病表现。然而,全身性红斑狼疮(SLE)在相对于内体TLR中的CGAS插入途径的贡献是有争议的。实际上,在FAS具有足够的SLE-Prone小鼠中,Sting缺乏效率未能营救,并实际上加剧了疾病表现。现在,我们将这些观察结果扩展到了i.p.诱导的SLE的慢性模型。注射TMPD(Pristane)。 我们发现,与CGAS刺激含量相比,CGA和刺激性不仅无法从TMPD诱导的SLE中拯救小鼠,而且导致自身抗体产生和蛋白尿水平更高,而蛋白尿水平则更高。 此外,我们使用CRISPR/CAS9在纯MRL/FAS LPR背景上产生了CGAS KO FAS LPR小鼠,发现疾病略微加剧,并且没有减弱。 我们假设CGAS插入途径会限制TLR激活,从而限制了这两个模型中的自身免疫性表现。 与此前提一致,与CGA或STING单一敲门动物相比,缺乏CGA和UNC93B1或Sting或Sting的小鼠会产生最小的全身自身免疫性。 尽管如此,B6小鼠中TMPD驱动的狼疮被废除了DNase I的AAV递送,暗示了DNA触发器。 总体而言,这项研究表明,CGAS刺激途径并不能促进SLE鼠模型中的全身自身免疫性。注射TMPD(Pristane)。我们发现,与CGAS刺激含量相比,CGA和刺激性不仅无法从TMPD诱导的SLE中拯救小鼠,而且导致自身抗体产生和蛋白尿水平更高,而蛋白尿水平则更高。此外,我们使用CRISPR/CAS9在纯MRL/FAS LPR背景上产生了CGAS KO FAS LPR小鼠,发现疾病略微加剧,并且没有减弱。我们假设CGAS插入途径会限制TLR激活,从而限制了这两个模型中的自身免疫性表现。与此前提一致,与CGA或STING单一敲门动物相比,缺乏CGA和UNC93B1或Sting或Sting的小鼠会产生最小的全身自身免疫性。尽管如此,B6小鼠中TMPD驱动的狼疮被废除了DNase I的AAV递送,暗示了DNA触发器。总体而言,这项研究表明,CGAS刺激途径并不能促进SLE鼠模型中的全身自身免疫性。这些数据对开发用于全身自身免疫性的CGAS定向疗法具有重要意义。
在新兴葡萄糖疗法的时代,丹麦患者的治疗轨迹
第一次在个人中首次开始,暗示使用药物是在给定药物类别的至少5 y中观察到的第一次使用。b在42%至49%之间的发起人没有最近可用的LDL测量。HBA1C缺失值的比例通常很低(≤2%)。记录的EGFR水平<60 ml/min/1.73m 2未通过另一个EGFR测量在≥90天内的另一个EGFR测量<60 mL/min/1.73m 2的确认,被编码为缺失,丢失水平为3%-8%。在降低葡萄糖疗法的类别中,蛋白尿缺失值的比例有所不同,并在表中报道。所有合并症均基于医院记录的诊断和程序。肾脏并发症还包括蛋白尿阶段A2-A3和/或EGFR <60 mL/min/min/1.73m 2。缩写:ACEI,血管紧张素转换酶抑制剂; ARB,血管紧张素II受体阻滞剂; DPP-4I,二肽基肽酶-4抑制剂; EGFR,估计的肾小球过滤率; GLP-1RA,胰高血糖素样肽1受体激动剂; IQR,四分位数范围; LDL,低密度脂蛋白; SGLT-2I,钠 - 葡萄糖共转运蛋白-2抑制剂; su,磺酰脲; UACR,尿白蛋白与造丁氨酸的比率。
脂肪营养剂,其他事先授权表格(...
男性 HDL-C ≤40 mg/dL 或女性 ≤50 mg/dL 视网膜病变 微量或大量白蛋白尿 ABI <0.9 其他: __________________________________________________________ 尝试过但失败了,或者对首选的脂肪营养药物有禁忌症或不耐受,其他经批准或医学上接受用于治疗受益人诊断的药物(请参阅 https://papdl.com/preferred-drug-list 以获取此类中首选和非首选药物的列表。) 空腹甘油三酯≥150 mg/dL 以下之一:
生物标志物测试及其在PNH中的作用
•阵发性夜间血红蛋白尿症(PNH)是一种罕见的慢性血液疾病,会导致您的血液,红细胞(RBC)的重要组成部分,以意外地破裂。这种分裂称为溶血•发生这种情况是因为您的血细胞缺少蛋白质,可保护它们免受人体免疫系统的一部分,称为补体系统•当您的RBC分解时,内部的血红蛋白会释放。血红蛋白是RBC的红色部分。其工作是在您的身体周围携带氧气
抽象引言这种慢性疾病...
由EGFR确定的肾功能的轨迹被发现是非线性的。 轨迹模式最初被归类为稳定,然后逐渐下降(75%);逐步下降(21.9%);和快速下降(3.1%)。 年龄较小,女性,马来人种族,低收入的住房类型,当前吸烟,较高的糖化血红蛋白,低密度脂蛋白,较高的甘油三酸酯,不受控制的血压,蛋白尿,心血管疾病,高血压,高血压,高血压和较高的EGFR水平与渐进率相关。 与最初稳定的轨迹相比,EGFR逐渐下降,渐进率下降使ESKD的危害增加了6.14倍(95%置信区间[CI]:4.96- 7.61),并迅速下降速度82.55倍(95%CI:55.90-121.89)。 见图5。由EGFR确定的肾功能的轨迹被发现是非线性的。轨迹模式最初被归类为稳定,然后逐渐下降(75%);逐步下降(21.9%);和快速下降(3.1%)。年龄较小,女性,马来人种族,低收入的住房类型,当前吸烟,较高的糖化血红蛋白,低密度脂蛋白,较高的甘油三酸酯,不受控制的血压,蛋白尿,心血管疾病,高血压,高血压,高血压和较高的EGFR水平与渐进率相关。与最初稳定的轨迹相比,EGFR逐渐下降,渐进率下降使ESKD的危害增加了6.14倍(95%置信区间[CI]:4.96- 7.61),并迅速下降速度82.55倍(95%CI:55.90-121.89)。见图5。