XiaoMi-AI文件搜索系统
World File Search System通过LC-MS/MS定量氨基酸,等离子体592 Umol/L H ...
这项测试是开发的,其性能特征由ARUP实验室确定。尚未获得美国食品药品监督管理局的清理或批准。该测试是在CLIA认证的实验室进行的,旨在用于临床目的。
粘多糖含量1/2型,硫酸乙酰肝素总和NRE(Sensi-Pro(R))定量,血清或血浆ARUP测试代码3003566
这项测试是开发的,其性能特征由ARUP实验室确定。尚未获得美国食品药品监督管理局的清理或批准。该测试是在CLIA认证的实验室进行的,旨在用于临床目的。
酰基肉碱定量概况,血浆患者-ARUP LAB
这项测试是开发的,其性能特征由ARUP实验室确定。尚未获得美国食品药品监督管理局的清理或批准。该测试是在CLIA认证的实验室进行的,旨在用于临床目的。
CCRVDF 报告美国代表
食品中兽药残留法典委员会 (CCRVDF) 于 2023 年 2 月 13 日至 17 日在俄勒冈州波特兰举行了第 26 届会议 (CCRVDF26),来自 50 个国家、一个成员组织(欧盟/EU)、七个观察员组织以及联合国粮食及农业组织 (FAO) 和世界卫生组织 (WHO) 的代表约 150 名代表出席了会议。美国食品药品管理局的 Brandi Robinson 主持了会议。美国代表包括代表 Jonathan Greene(美国食品药品管理局)、候补代表 Louis Bluhm(美国农业部食品安全检验局)、七名政府顾问和三名非政府顾问。CCRVDF26 是该委员会自 2018 年以来首次举行面对面会议。
J&J 疫苗说明书_v2
截至 2021 年 3 月,辉瑞、Moderna 和杨森(强生)COVID-19 疫苗已获得美国食品药品管理局 (FDA) 的紧急使用授权 (EUA)。以下是有关杨森(强生)COVID-19 疫苗的一些重要事实。
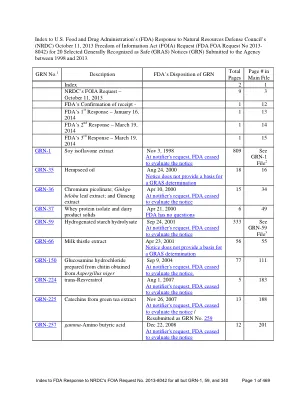
NRDC:食品中化学物质的安全漏洞 - FDA 对 NRDC FOIA 请求编号 2013-8042(除 GRN-1、59 和 340 外)的回应索引 (PDF)
2013 年 10 月 11 日 通过传真和挂号邮件 食品药品管理局 信息自由司 共享服务办公室 公共信息和图书馆服务办公室 12420 Parklawn Drive ELEM-1029 Rockville, MD 20857 传真:(301) 827-9267 事由:FOIA 要求提供有关机构收到的一般公认安全通知的记录 尊敬的 FOIA 官员: 我代表自然资源保护委员会 (NRDC) 写信,请求根据《信息自由法》(“FOIA”),5 U.S.C. 披露记录。§ 552 和适用的食品药品管理局 (FDA) 法规,21 C.F.R.第 20 部分。I.所寻求记录的描述 请提供 FDA 在 2013 年 9 月 30 日或之前持有、保管或控制的与附录 A 中描述的一般公认安全 (GRAS) 通知相关的记录 1。我们特别寻求以下记录:
FDARA 分子靶向肿瘤药物儿科研究实施指南:FD&C 法案第 505B 条修正案 - 行业指南
1 本指南由美国食品药品管理局肿瘤卓越中心与药品评估与研究中心以及生物制品评估与研究中心合作制定。 2 在本指南中,药品和药品产品包括根据《联邦食品药品和化妆品法案》(FD&C 法案)第 505 节批准的药品(21 USC 355)和根据《公共卫生服务法案》第 351 节许可的生物制品(42 USC 262)。 3 有关 PREA 要求和拟议生物仿制药产品的更多信息,请参阅行业指南草案《生物仿制药开发和 BPCI 法案新修订问答草案》(修订版 2)(2018 年 12 月)中的 QI16。(最终版本将代表 FDA 目前对此主题的看法)。 4 公法 115-52、131 Stat. 1005(2017 年 8 月 18 日)。
213535Orig1s000 临床评论 - accessdata.fda.gov
AC 咨询委员会 AE 不良事件 BLA 生物制品许可申请 BPCA 最佳儿童药物法案 BRF 效益风险框架 CBER 生物制品评价与研究中心 CCOD 临床截止日期 CDER 药品评价与研究中心 CDRH 设备和放射健康中心 CDTL 跨学科团队负责人 CFR 联邦法规 CHOP INTEND 费城儿童医院婴儿神经肌肉疾病检测 CMC 化学、制造和控制 COSTART 不良反应术语库的编码符号 CRF 病例报告表 CRO 合同研究组织 CRT 临床审查模板 CSF 脑脊液 CSR 临床研究报告 CSS 管制物质工作人员 DMC 数据监测委员会 ECG 心电图 eCTD 电子通用技术文档 ETASU 确保安全使用的要素 FDA 食品药品管理局 FDAAA 2007 年食品药品管理局修正案 FDASIA 食品药品管理局安全和创新法案 FEV1 1 秒用力呼气量 FVC 用力肺活量 GCP良好的临床实践 GRMP 良好的评审管理实践 HFMSE 汉默史密斯功能运动量表 - 扩展版 HINE 汉默史密斯婴儿神经系统检查 ICH 国际协调会议 iDMC 独立数据监察委员会 IMC 独立监察委员会 IND 研究性新药 ISE 疗效综合总结
当谈到呼吸道合胞病毒时,你做主
RSV 的严重程度。美国食品药品管理局 (FDA) 已批准,美国疾病控制与预防中心 (CDC) 也推荐母体 RSV 疫苗和婴儿 RSV 单克隆抗体,这提供了两种机会来预防 RSV 的负面副作用。