XiaoMi-AI文件搜索系统
World File Search System为供应商提供的猴痘疫苗资源
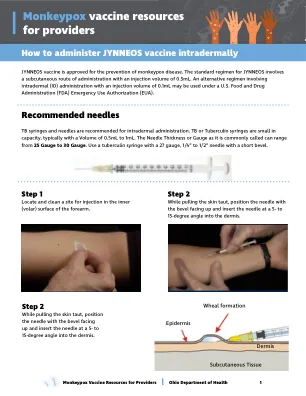
JYNNEOS 疫苗获批用于预防猴痘病。JYNNEOS 的标准方案是皮下给药,注射量为 0.5 毫升。根据美国食品药品监督管理局 (FDA) 的紧急使用授权 (EUA),可以使用皮内 (ID) 给药的替代方案,注射量为 0.1 毫升。
病毒载体covid-19疫苗:神话与事实
梵蒂冈和美国天主教主教会议认为,“在道德上接受一种使用堕胎衍生的细胞系的疫苗……在道德上可以接受……”,不仅要“保护自己的健康,而且还有责任追求共同利益”。本质上,任何可用的食品药品监督管理局(FDA)和紧急使用授权(EUA)批准的疫苗都是适当的疫苗。
联合健康保险社区和州
• CMS – 医疗保险和医疗补助服务中心 • DOS – 服务日期 • EDI – 电子数据交换 • EOB – 福利说明 • FDA – 食品药品管理局 • HCFA – 医疗保健财务管理局 • INN – 网络内 • NDC – 国家药品代码 • OON – 网络外 • PAR – 参与 • RFP – 参与请求 • UHC – 联合健康保险
COVID-19 疫苗更新
疫苗安全有效吗?是的。疫苗经过了多项安全性和临床试验,并经过了美国食品药品管理局 (FDA) 和美国疾病控制中心 (CDC) 的审查。世界各地还进行了多次疫苗试验,参与者来自不同种族、年龄和民族。疫苗安全有效,预防 COVID-19 的成功率高达 95%。
提供商的Monkeypox疫苗资源
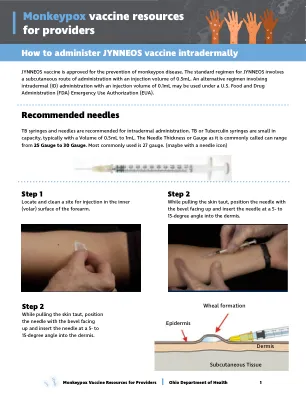
jynneos疫苗被批准用于预防蒙基毒素疾病。jynneos的标准方案涉及一条皮下途径,注射体积为0.5ml。根据美国食品药品监督管理局(FDA)紧急使用授权(EUA),可以使用涉及注射量为0.1ml的皮内(ID)给药的替代方案。
新药和生物制品利益风险评估行业指南
I. 引言 本指导原则旨在向药品申办方和其他利益相关者阐明,在药品的获益、风险和风险管理方案的考虑如何影响美国食品药品管理局(FDA 或 Agency)对根据联邦食品药品和化妆品法案(FD&C Act)第 505(b) 节(21 USC 355(b))提交的新药申请(NDA)以及根据公共卫生服务法案(PHS Act)第 351(a) 节提交的生物制品许可申请(BLA)所做出的某些上市前和上市后监管决策。本指导原则首先阐明了药品审评和研究中心(CDER)和生物制品审评和研究中心(CBER)进行获益-风险评估时需要考虑的重要因素,包括如何使用患者体验数据 4 为获益-风险评估提供信息。然后,指导原则讨论了申办方如何通过设计和实施开发计划为 FDA 的获益-风险评估提供信息,以及他们如何在临床试验中展示获益和风险。营销应用中的风险信息。它还讨论了
对流感的强烈防御: - 接种疫苗!
流感疫苗具有良好的安全记录。数亿美国人安全接收了流感疫苗。广泛的研究支持季节性流感疫苗的安全性。每年,CDC与美国食品药品监督管理局(FDA)和其他合作伙伴合作,以确保流感疫苗的最高安全标准。有关流感疫苗安全性的更多信息,请访问www.cdc.gov/flu/protect/vaccine/vaccinesafety.htm。
风险评估与缓解策略 (REMS) 计划培训
REMS 计划是一种管理与药物相关的已知或潜在风险的策略,是美国食品药品管理局 (FDA) 的要求,以确保药物的益处大于其风险。由于存在严重的细胞因子释放综合征 (CRS) 和神经毒性风险,YESCARTA 和 TECARTUS 仅在名为 YESCARTA 和 TECARTUS REMS 计划的计划下提供。