机构名称:
¥ 1.0
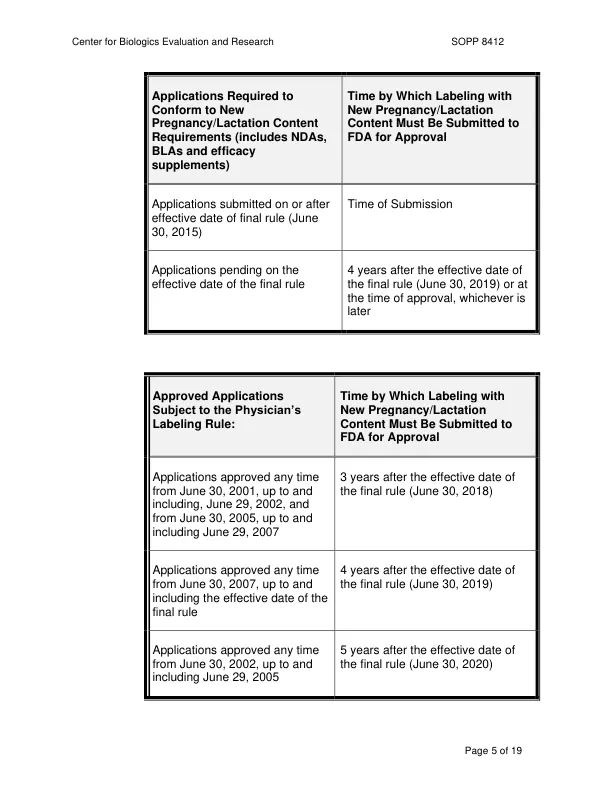
2013 年 2 月,美国食品和药物管理局(FDA)颁布了一项新的标签法规(PLR),要求从 2006 年 6 月 30 日起,BLA 和 NDA 的标签须符合 21 CFR 201.56 和 201.57。对于 2001 年 6 月之前批准的 BLA、NDA 和功效补充剂,PLR 的实施是自愿的。PLR 修订了现有的标签法规,要求新的和最近批准的人用药品和生物制品的处方信息除了完整的处方信息外,还要包括交叉引用的重点部分和目录。它还建立了某些必需内容、标签的重新排序和最低格式要求。PLR 的目的是使处方信息更易于理解和参考,以便从业者改善风险和收益沟通以及风险管理。有关更多信息,请参阅行业指南:人用处方药和生物制品标签 — 实施 PLR 内容和格式要求(2013 年 2 月)。
SOPP 8412:产品标签审查