机构名称:
¥ 3.0
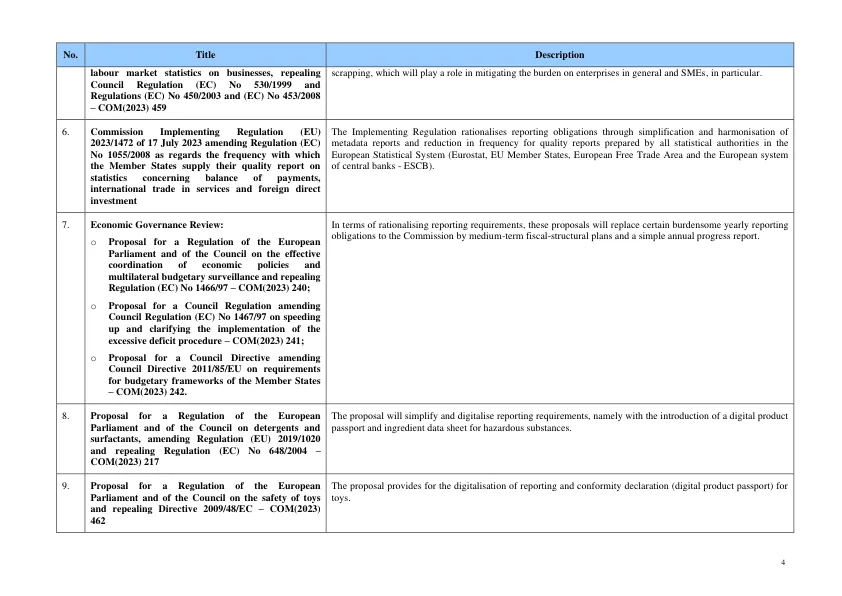
修订后的框架包括取消某些报告要求,例如要求罕见病药品开发商每年向欧洲药品管理局提交一份关于罕见病药品或儿童药品研发状况的报告;要求成员国报告国家为支持罕见病药品或儿童药品的研究、开发和供应所采取的措施;要求提供治疗需求清单信息;要求成员国报告其放弃某些制造要求的情况;要求成员国报告对需要医生处方的授权药品清单所做的更改。它还规定减少对药物警戒系统审计的报告频率。
斯特拉斯堡,2023 年 10 月 17 日 COM(2023) 638 最终附件 1 至......