机构名称:
¥ 1.0
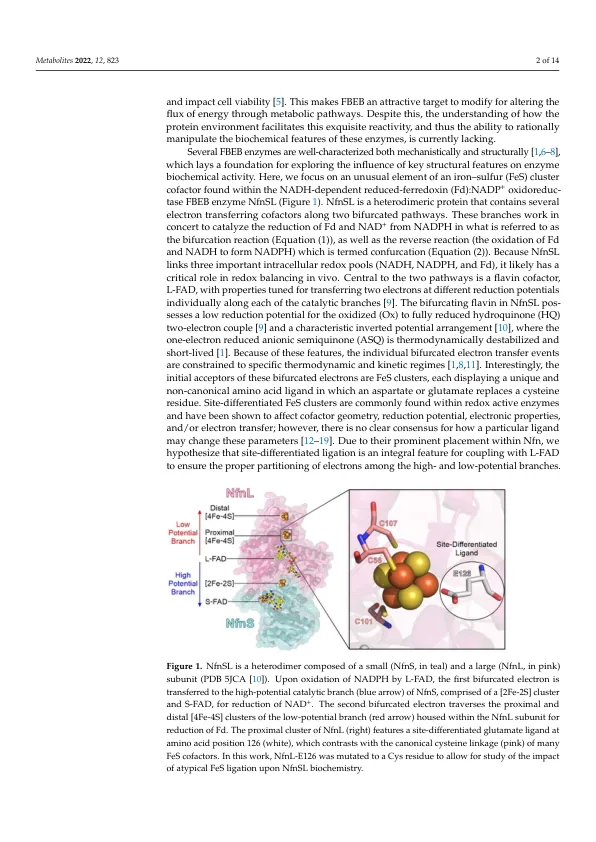
摘要:电子分叉是一种巧妙的生物能量转换机制,可有效耦合三种不同的生理相关底物。因此,执行此功能的酶通常在调节细胞氧化还原代谢中起关键作用。一种这样的酶是 NADH 依赖性还原铁氧还蛋白:NADP + 氧化还原酶 (NfnSL),它将 NAD + 的热力学有利还原耦合以驱动铁氧还蛋白从 NADPH 的不利还原。NfnSL 与其底物的相互作用被限制在严格的化学计量条件下,这可确保非生产性分子内电子转移反应的能量损失最小。然而,决定这一情况的因素尚不清楚。NfnSL 的一个奇怪特征是,分叉电子的两个初始受体都是独特的铁硫 (FeS) 簇,每个簇包含一个非半胱氨酸配体。尽管位点分化的 FeS 配体在许多氧化还原活性酶中都存在,但它们的生化影响和机制作用仍是谜。在此,我们描述了野生型 NfnSL 和变体的生化研究,其中位点分化的配体之一已被半胱氨酸取代。基于染料的稳态动力学实验、底物结合测量、生化活性测定和酶中电子分布评估的结果表明,NfnSL 中的这种位点分化配体在维持两种电子转移途径执行的协调反应的保真度方面发挥作用。鉴于这些辅助因子的共性,我们的发现具有广泛的意义,超越了电子分叉和机械生物化学,并可能为调节细胞氧化还原平衡的方法提供信息,以实现有针对性的代谢工程方法。
位点分化的铁硫簇连接影响基于黄素的电子分叉活性
主要关键词