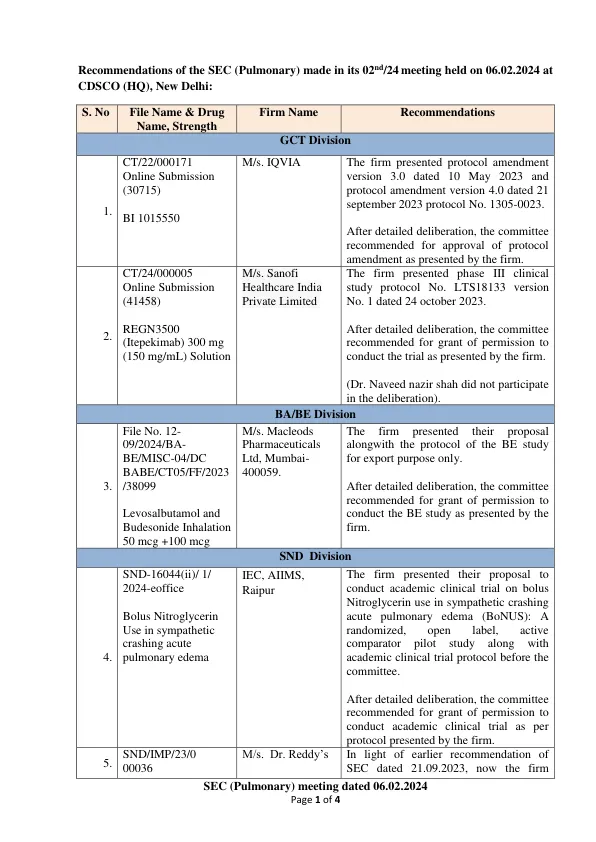
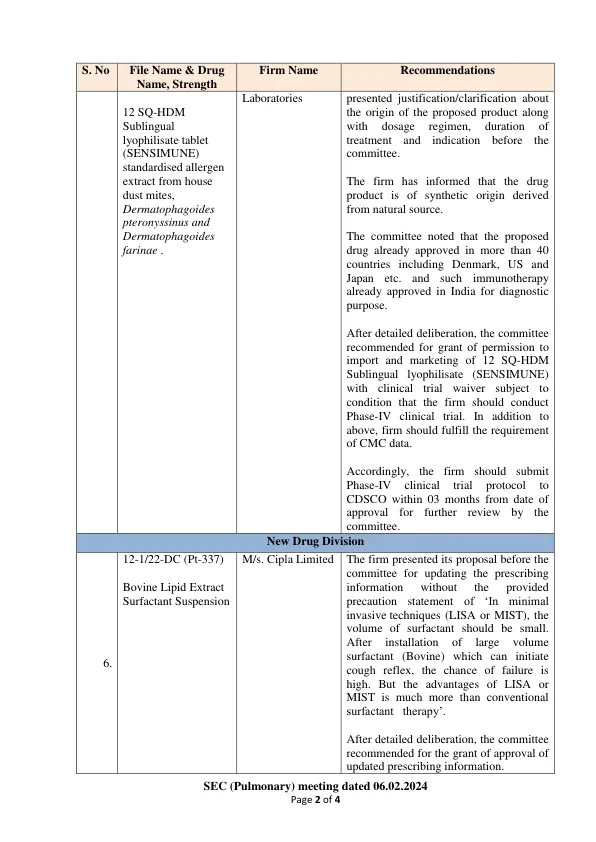
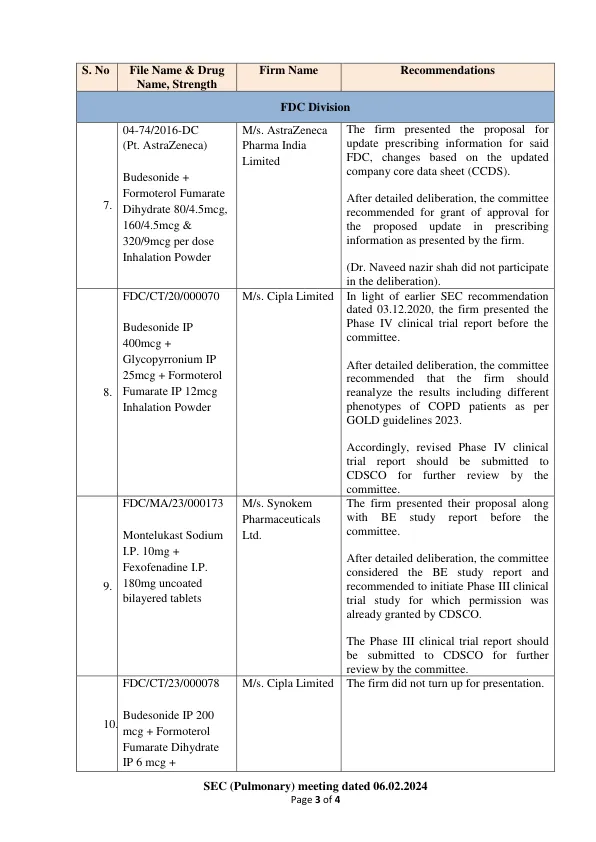
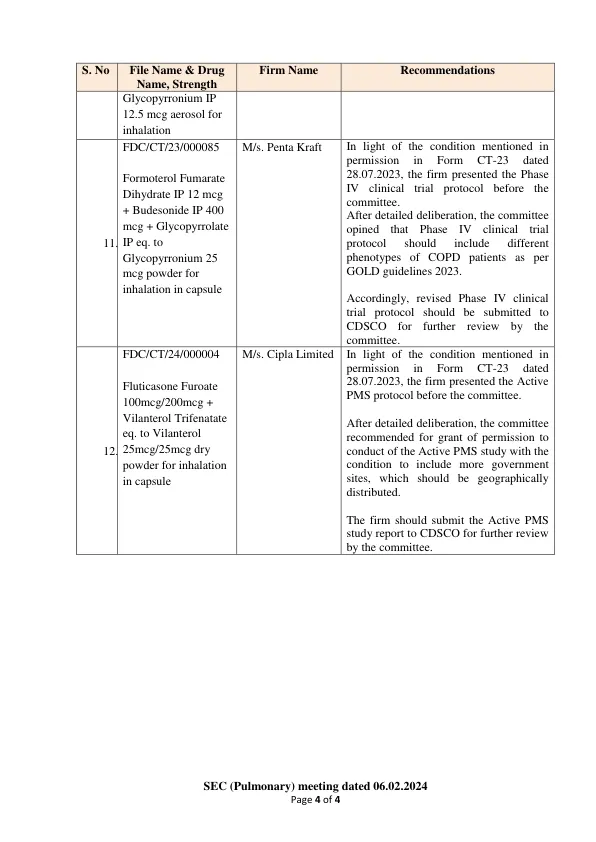
机构名称:
¥ 1.0
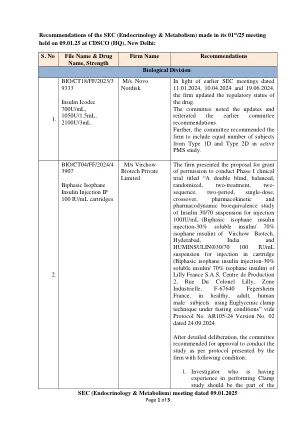
实验室对拟议产品的起源以及剂量方案,治疗持续时间以及委员会面前的指示提出了理由/澄清。该公司已告知该药物是从天然来源衍生的合成起源。委员会指出,拟议中的药物已经在丹麦,美国和日本等40多个国家/地区批准。和此类免疫疗法已经在印度批准出于诊断目的。经过详细的审议,委员会建议授予许可,以进口和销售12平方英尺的舌下卵裂状(Sensimune),并进行临床试验豁免,但条件应该公司进行阶段IV临床试验的条件。除上述外,公司还应满足CMC数据的要求。因此,公司应在批准之日起03个月内向CDSCO提交阶段IV临床试验方案,以便受到委员会的进一步审查。新药师
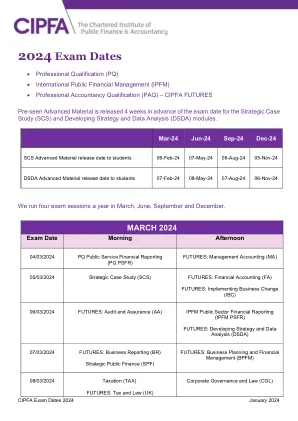
sec(肺)会议日期为06.02.2024