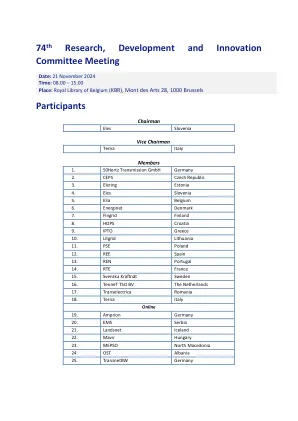
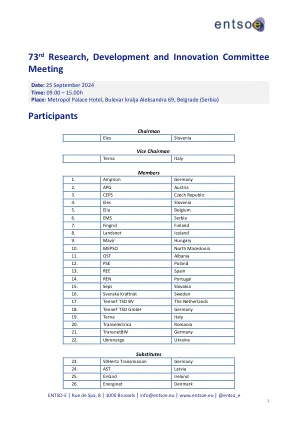
Trade/Device Name: DEKA ACE Pump System Regulation Number: 21 CFR 880.5730 Regulation Name: Alternate Controller Enabled Infusion Pump Regulatory Class: Class II Product Code: QFG, NDC Dated: April 26, 2024 Received: April 29, 2024 Dear Paul Smolenski: We have reviewed your section 510(k) premarket notification of intent to market the device referenced above and have determined the device is substantially equivalent (for the indications for use stated in the enclosure) to legally marketed predicate devices marketed in interstate commerce prior to May 28, 1976, the enactment date of the Medical Device Amendments, or to devices that have been reclassified in accordance with the provisions of the Federal Food, Drug, and Cosmetic Act (the Act) that do not require approval of a premarket approval application (PMA).因此,您可能会销售该设备,但要遵守该法案的一般控制条款。尽管这封信将您的产品称为设备,但请注意,一些清除的产品可能是组合产品。510(k)上市通知数据库可在https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfdocs/cfpmn/pmn.cfm识别组合产品提交。该法案的一般控制条款包括年度注册,设备上市,良好的制造实践,标签和禁止品牌和掺假的禁令。请注意:CDRH不评估与合同责任保证有关的信息。我们提醒您,设备标签必须是真实的,不要误导。此外,FDA可能会在联邦登记册中发布有关您的设备的进一步公告。如果您的设备被分类(请参见上文)为II类(特殊控件)或III类(PMA),则可能会受到其他控件的约束。可以在《联邦法规》第21章,第800至898部分中找到影响您设备的现有主要法规。在FDA指南文件中提供了有关可能需要新的前市场通知的其他信息,题为“决定何时提交510(k)以更改现有设备”(https://wwwww.fda.gov/media/media/99812/99812/download),并“决定何时提交510(k)现有设备(k)(K)的设备(K) https://www.fda.gov/media/99785/download)。
2024年5月24日DEKA研究与发展Paul ...
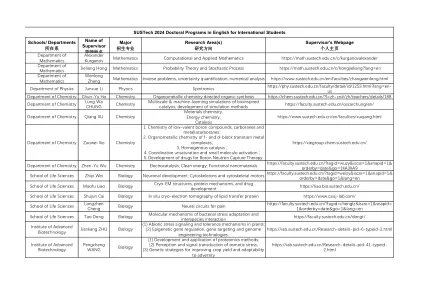
主要关键词