XiaoMi-AI文件搜索系统
World File Search System创临床试验质变” --AI 助力临床试验发展》培训班的通知
李坤艳湖南省肿瘤医院 余勤 四川大学华西第二医院 孙涛 辽宁省肿瘤医院 倪穗琴广州市第一人民医院 王淑民首都医科大学北京朝阳医院 元刚 中山大学附属第一医院 强生(中国)投资有限公司代表
间充质干细胞防治移植物抗宿主病临床试验技术指导原则
一、概述 ............................................................................................................... 1
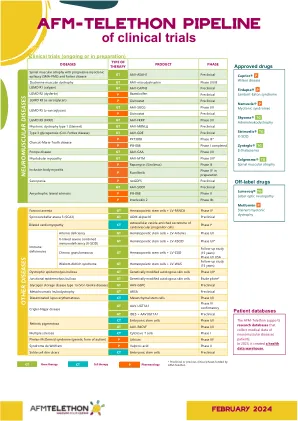
临床试验
感谢我们的慷慨捐助者,到目前为止,他们为研究贡献了超过800万美元,也感谢Roger J. Packer博士的不懈努力,Roger J. Packer博士不懈地协调了我们壮观的科学家群体,分布在美国,加拿大,加拿大和德国的13个实验室中 - 我们正在迅速前进。我很高兴地宣布,我们预计患者的两次临床试验仅在6到12个月内开始!此外,在不久的将来,我们在管道中还有另外两个临床试验!所有这些都是我们的捐助者和科学家的巨大努力的结果,他们决定改变脑肿瘤儿童的悲伤状况,这些儿童在研究投资中被忽视。现在,随着试验,我们越来越接近挽救数千人生命!但是,期待已久的临床试验阶段是找到髓母细胞瘤的治疗方法的最后一段时间,需要大量投资来招募,治疗和关注患者。我们希望我们可以继续依靠到目前为止所获得的支持,并在这项工作中获得新的合作伙伴。我们知道,只有研究才能找到治疗方法,并且正如塔木德(Talmud)所写的那样:“拯救一个生命的人,拯救了整个世界。”
临床试验附录
Tagrisso + Orpathys – EGFR m NSCLC (SAFFRON) Imfinzi – resectable GC/GEJC (MATTERHORN) Imfinzi – non-muscle-invasive bladder cancer (POTOMAC) Imfinzi – muscle-invasive bladder cancer (VOLGA) Enhertu – high-risk early HER2+ breast cancer (adjuvant) (DESTINY-Breast05) Enhertu - Her2+见面。乳腺癌(1L)(Destiny-Breast09)Datroway+ Imfinzi - 非Quamous/non-squamoustrop2+ NSCLC(1L)(Avanzar)ComizEstrant - ESR1 MHR+ HER2- MET。乳腺癌(1L开关)(SERENA-6)塞拉氏菌 - 近距离(latify)Fasenra - 中度至重度COPD(溶性)Saphnelo - 中度至重度SLE(Tulip-sc)Baxdrostat - 未控制的高压(BAXHTN)Ultomiris - ultomiris - hsct-tma-hsct-tma(Alxn1210) Anselamimab - Al淀粉样变性(Mayo STG。iiia/b)(CAEL101-302)/CAEL101-301)GEFURULIMAB - 肌无力 - 肌无力(ALXN1720-MG-301)efzimfotase alfa - hypophosphatasia(Hickory/div>
临床试验附录
Tagrisso – EGFRm NSCLC(SAFFRON) Imfinzi – 非肌层浸润性膀胱癌(POTOMAC) Imfinzi – 膀胱癌(肌层浸润性)(NIAGARA) Imfinzi – GC/GEJC(切除性)(MATTERHORN) Imfinzi – 肌层浸润性膀胱癌(VOLGA) Enhertu – 高风险 HER2+ 早期乳腺癌(DESTINY-Breast05) Enhertu – HER2+ 转移。乳腺癌 (1L) (DESTINY-Breast09) Enhertu – 高风险 HER2+ 早期乳腺癌(未转移)(DESTINY-Breast11) Enhertu – HER2+ 胃癌 (2L) (DESTINY-Gastric04) Enhertu – HER2m NSCLC (DESTINY-Lung04) Calquence – 未曾治疗的慢性淋巴细胞白血病 (AMPLIFY) Calquence – 未曾治疗的套细胞淋巴细胞 (ECHO) camizestrant – HR+/HER2-neg 乳腺癌 (SERENA-6) ceralasertib – 输注后 NSCLC (LATIFY) Dato-DXd – NSCLC (1L) (AVANZAR)