XiaoMi-AI文件搜索系统
World File Search System乙肝疫苗——你需要知道的
对于肠套叠,请留意伴随剧烈哭闹的胃痛迹象。早期,这些症状可能仅持续几分钟,并在一小时内反复发作数次。婴儿可能会将双腿拉到胸前。您的宝宝还可能会呕吐数次或大便带血,或者显得虚弱或非常烦躁。这些迹象通常发生在接种第一剂或第二剂轮状病毒疫苗后的第一周,但接种疫苗后任何时候都应注意这些迹象。如果您认为您的宝宝患有肠套叠,请立即联系医疗保健提供者。如果您无法联系到您的医疗保健提供者,请带您的宝宝去医院。告诉他们您的宝宝何时接种了轮状病毒疫苗。
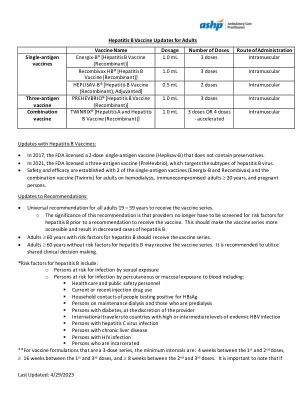
成人乙肝疫苗更新
1. Energix-B [乙肝疫苗(重组)] [处方信息]。北卡罗来纳州三角研究园:葛兰素史克生物制品公司;2021 年。2. Recombivax HB [乙肝疫苗(重组)] [处方信息]。新泽西州拉威:默克公司;2023 年。3. Heplisav-B [乙肝疫苗(重组),佐剂型] [处方信息]。加利福尼亚州埃默里维尔:Dynavax; 4. Prehevbrio [乙肝疫苗(重组)] [处方信息]。VBI 疫苗;2021。5. Heplisav-B [乙肝疫苗(重组),佐剂] [处方信息]。加利福尼亚州埃默里维尔:Dynavax;2020。6. 疾病控制和预防中心。病毒性肝炎:健康专业人员常见问题。2022 年 3 月 30 日更新。2023 年 4 月 29 日访问。https://www.cdc.gov/hepatitis/hbv/hbvfaq.htm#vaccFAQ 7. Schillie S、Harris A、Link-Gelles R、Romero J、Ward J、Nelson N。免疫实践咨询委员会关于使用新型佐剂的乙肝疫苗的建议。MMWR Morb Mortal Wkly Rep. 2018;67:455-458。http://dx.doi.org/10.15585/mmwr.mm6715a5 8. Immunize.org。乙型肝炎:咨询专家。2022 年 5 月 26 日更新。2023 年 4 月 29 日访问。https://www.immunize.org/askexperts/experts_hepb.asp#adult
乙肝疫苗拒绝接种表及豁免
❑ 我目前拒绝接种乙肝疫苗。我明白,拒绝接种此疫苗将使我继续面临感染乙肝这一严重疾病的高风险。我还明白,如果我不接种疫苗,一些健康职业临床站点可能不会接受我,这将减少我临床经验的选择。如果我在指定的临床站点工作期间感染或感染乙肝病毒,我还将免除奥克顿学院的任何和所有索赔或诉讼。我已阅读并理解本拒绝表中的所有条款,并自愿无条件地执行本拒绝表。
乙肝疫苗肾病患者组指导(PGD)
参考编号:乙肝肾脏 PGD 版本编号:v4.00 有效期:2023 年 4 月 30 日 审核日期:2024 年 9 月 30 日 到期日期:2025 年 4 月 30 日 英国健康安全局 (UKHSA) 制定了此 PGD,以按照国家建议促进在英格兰开展公共资助的免疫接种。使用此 PGD 的人员必须确保它已获得组织授权,并由适当的授权人员在第 2 部分中签署,该授权人员与将提供产品的人员类别有关,符合《2012 年人用药品条例》(HMR2012) 1 的规定。如果没有根据 HMR2012 附表 16 第 2 部分签署的授权,则 PGD 不合法或无效。授权组织不得更改、修改或添加本文件的临床内容(第 4、5 和 6 部分);此类操作将使提供的临床签字无效。此外,授权机构不得更改第 3 节“员工特征”。仅可在提供的指定可编辑字段内修改第 2 节和第 7 节。本 PGD 的实施由委托人和服务提供商负责。如果 PGD 仅与成人有关,授权机构应在 PGD 到期后保留本 PGD 的最终授权副本 8 年,如果 PGD 仅与儿童或成人和儿童有关,则应在 PGD 到期后保留 25 年。采用本 PGD 授权版本的提供商组织也应在上述期限内保留副本。个人从业者在根据本 PGD 的当前版本开展工作之前,必须根据本 PGD 的当前版本获得授权。从业者和组织必须检查他们是否正在使用 PGD 的当前版本。在公布的到期日之前,可能需要进行修改。当前版本的 UKHSA PGD 授权模板可从以下网址找到:www.gov.uk/government/collections/immunisation-patient-group-direction-pgd 如对本 PGD 内容有任何疑问,请联系:immunisation@ukhsa.gov.uk 如对组织授权的 PGD 可用性以及本 PGD 后续版本的咨询,请联系:
对于患有乙肝病毒的母亲所生的婴儿
1) 向该妇女提供 NHS 苏格兰传单 — 为患有乙肝的母亲所生婴儿接种乙肝疫苗 — 英语、易读、波兰语、乌尔都语和中文版本,可在 NHS Inform 网站获取,网址为 https://www.nhsinform.scot/healthy- living/immunisation 2) 将初始通知表(第 8 页)发送给健康保护团队。 3) 确保计划记录在 TRAK 的“新生儿管理计划”下,a) 为所有乙肝阳性母亲所生婴儿接种乙肝疫苗时间表,以及 b) 如有指示,接种乙肝免疫球蛋白 (HBIG)。 4) 将贴纸(第 15 页)贴在便条上,提醒产房/产后助产士需要接种乙肝疫苗(如果也表明需要接种 HBIG,请使用额外的贴纸)。 5) 将此资源包插入妇女的病历记录中,以便在分娩时再次使用。 6) 确保该妇女已转诊至 Bathgate 医生的肝炎诊所,或已在 RIDU 接受随访。
乙肝疫苗高剂量接种计划
患有晚期肝病(如肝硬化、医生诊断的与丙型肝炎感染相关的晚期肝病)且对初始乙肝疫苗系列(标准剂量)无反应的个人,应按照“乙肝疫苗高剂量计划”进行第二系列免疫。接种后血清学检查:在完成疫苗系列后 1-6 个月测量抗 HBs,以确保已达到足够的免疫反应。如果抗 HBs ≥ 10 IU/L,则考虑免疫。如果抗 HBs < 10 IU/L,则提供第二系列疫苗并在 4 周后重新评估抗 HBs。如果抗 HBs 仍然 < 10 IU/L,则考虑为 2 系列无反应者并易患乙肝。进一步接种疫苗没有好处。如果接触血液或体液,客户将需要接触后预防。注意:如果在完成疫苗系列 6 个月后进行接种后血清学检查,滴度可能会低估该系列所实现的保护作用。抗 HBs ≥ 10 IU/L 者视为免疫。但是,如果抗 HBs < 10 IU/L 且:
治愈乙肝需要什么?
缩写:AASLD,美国肝病研究协会;ALT,丙氨酸氨基转移酶;ASO,反义寡核苷酸;CAM,衣壳组装调节剂;cccDNA,共价闭合环状DNA;ChAdOx1-HBV/MVA-HBV,编码多种 HBV 抗原的黑猩猩腺病毒和改良痘苗安卡拉病毒载体;CHB,慢性乙型肝炎感染;EASL,欧洲肝脏研究协会;ETV,恩替卡韦;GalNac 共轭 LNA SSO,N-乙酰半乳糖胺共轭锁核酸单链寡核苷酸;HBcrAg,乙型肝炎核心相关抗原;HBeAg,乙型肝炎 BE 抗原;HBsAg,乙型肝炎表面抗原;HBV,乙型肝炎病毒;HCC,肝细胞癌;IFN,干扰素; MDSC,髓系抑制细胞;NA,核苷(酸)类似物;NAP,核酸聚合物;NK 细胞,自然杀伤细胞;NTCP,牛磺胆酸钠共转运多肽;PD-1,程序性死亡受体-1;PDL-1,程序性细胞死亡配体-1;pegIFN α,聚乙二醇化干扰素α;pgRNA,前基因组RNA;siRNA,小干扰RNA;STOP,S-抗原运输抑制寡核苷酸聚合物;TAF,替诺福韦艾拉酚胺;TCR,T 细胞受体;TDF,富马酸替诺福韦二吡呋酯;TGF,转化生长因子;TLR,Toll 样受体。
FINALv3_行动呼吁:普遍开展乙肝筛查和疫苗接种 2023.03.13
更新乙肝病毒筛查和疫苗接种建议的理由 以前基于风险的乙肝筛查和疫苗接种指南面临几大实施障碍,包括耻辱感和临床医生评估众多风险因素的负担。事实上,在一项全国性调查中,68% 的医生认为患者不披露风险因素是成人接种疫苗的障碍,44% 的医生报告说他们没有足够的时间定期评估患者的风险因素。此外,发送给疾病控制和预防中心 (CDC) 的急性乙肝病例报告中,三分之二缺少风险数据或报告未发现风险。事实上,由于风险可能是暂时的和未被认识到的,任何人都可能感染乙肝。修订后的指南取消了筛查或接种疫苗前进行风险评估的需要,并提供了一个简化的框架来确定成人是否需要进行乙肝筛查或接种疫苗(图 2)。