XiaoMi-AI文件搜索系统
World File Search System截至 2020 年日本监管部门批准的基于深度学习/机器学习的医疗器械:系统评价
机器学习 (ML) 和深度学习 (DL) 正在改变世界并重塑医学领域。因此,我们进行了系统评价,以确定日本(国际监管协调的主要利益相关者)监管批准的基于 ML/DL 的医疗器械的现状。医疗器械的信息来自日本医疗设备促进协会的搜索服务。医疗器械中 ML/DL 方法的使用通过公开声明进行确认,当公开声明不足以确认时,则通过电子邮件联系营销授权持有人。在发现的 114,150 台医疗器械中,有 11 台是监管机构批准的基于 ML/DL 的医疗器械软件,其中 6 种产品(54.5%)与放射学有关,5 种产品(45.5%)与胃肠病学有关。国内的基于 ML/DL 的医疗器械软件大多与日本常见的健康检查有关。我们的审查有助于了解全球概况,从而促进国际竞争力和进一步的定制进步。
MDCG 2023-3 rev.2 - 公共卫生 - 欧盟委员会
本文件旨在阐明《医疗器械条例》(EU) 2017/745 第 VII 章第 2 节和《体外诊断医疗器械条例》(EU) 2017/746 第 2 节概述的重要术语和概念。建立对这些术语和概念的共同理解对于有效和协调地实施这些条例下的警戒要求是必要的。该文件是为主管当局、经济运营商和其他相关方编写的。本文件中提出的一些定义是从《医疗器械警戒系统指南》1 中重新引入的,并在相关情况下进行了修改以与 MDR 和 IVDR 保持一致。除非直接引用法律文本或另有规定,否则术语“设备”应理解为包括医疗器械、医疗器械配件、MDR 附件 XVI 中列出的产品、体外诊断医疗器械和体外医疗器械配件。此外,对“条例”的引用应理解为涵盖 MDR 和 IVDR。本文件并非详尽无遗,应与法规、相关标准 2 和 MDCG 指导文件 3 结合阅读。
机器学习医疗设备——人工智能医疗设备的子集:关键术语和定义
人工智能医疗器械子集:关键术语和定义 编写组:IMDRF AIMD 工作组 日期:2021 年 9 月 16 日 本文件由国际医疗器械监管机构论坛制作。本文件的复制或使用不受限制;但是,将本文件的全部或部分纳入其他文件,或将其翻译成英语以外的语言,并不表示或代表国际医疗器械监管机构论坛的任何形式的认可。版权所有 © 2021 国际医疗器械监管机构论坛。
经济经营者义务信息表 CH
继 2021 年 5 月 26 日《医疗器械条例》修订版生效后,联邦委员会于 2022 年 5 月 26 日颁布了新的《体外诊断医疗器械条例》。为确保质量、安全和功效标准与欧盟成员国的标准一致,该立法以新的欧盟医疗器械法规 ( MDR 1 ) 和体外医疗器械法规 ( IVDR 2 ) 为基础。根据之前的法规(指令 90/385/EEC、93/42/EEC 和 98/79/EC),瑞士与欧盟关于相互认可合格评定的协议(相互认可协议或 MRA)使瑞士能够在平等伙伴关系的基础上进入欧洲医疗器械单一市场。由于 MRA 未于 2021 年 5 月 26 日更新,瑞士已制定措施,旨在限制这一发展带来的负面影响,特别是瑞士当局无力
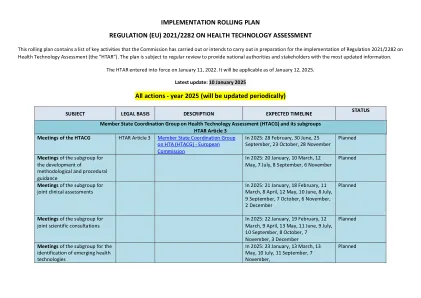
实施滚动计划条例(EU)2021 ...
实施条例 - EU - 2024/2699 - EN - EUR-Lex,根据欧洲议会和理事会条例 (EU) 2021/2282,制定了成员国卫生技术评估协调小组和委员会与欧洲药品管理局在药品和医疗器械联合临床评估和体外诊断医疗器械以及药品和医疗器械联合科学咨询方面进行信息交换的详细程序规则
“人工智能、法律与伦理”问题与解决方案
(示例)人工智能医疗项目与《药品和医疗器械法》之间的冲突 有时,您可能需要在人工智能业务启动之前甚至之后推迟或取消其计划,例如,人工智能医疗项目与《药品和医疗器械法》之间的冲突药品和医疗器械等产品的质量、功效和安全”
基于ISO/IEC 42001的人工智能——管理体系构建方法
我将谈谈医疗器械开发所需的各种法规。其中一项标准就是目前流行的ISO/IEC 42001(信息技术 — 人工智能 — 管理系统),我们将讲解其内容,包括其与ISO 14971的相关性。此外,我们还将讨论《药品和医疗器械法》下的人工智能视角以及医疗器械设计和开发阶段需要注意的事项。
医疗广告:联邦设备监管
医疗器械广告通过各种媒体直接传达给消费者,包括广播、印刷品、互联网和社交媒体平台。美国卫生与公众服务部 (HHS) 下属的食品药品管理局 (FDA) 和联邦贸易委员会 (FTC) 共同负责监督美国医疗器械的直接面向消费者的广告。1 医疗器械包括范围广泛的产品,例如任何仪器、设备、器具、机器、器具、植入物、体外试剂或用于诊断或治疗疾病的软件。2 市场上有数百万种医疗器械,它们可以在柜台上出售(例如血压监测仪和生育跟踪移动应用程序)、凭处方出售(例如隐形眼镜和牙齿矫正器)或根据其他监管限制出售(例如心脏起搏器)。自 2009 年以来,我们已将 FDA 对医疗产品(包括医疗器械)的监管列入 GAO 的高风险名单。3
苏格兰的人工智能和医疗保健
在撰写本文时,英国脱欧后,英国医疗器械监管正处于过渡阶段。它仍受《2002 年医疗器械法规》(经修订)的约束,该法规将相关欧盟指令转化为英国法律。新的英国监管制度最初是通过《2021 年药品和医疗器械法案》引入的,目的是利用这些权力在 2023 年 7 月 1 日制定次级立法。17 然而,英国政府推迟了这一期限,并延长了之前欧盟标准的适用时间。根据目前的做法,医疗器械根据 CE 标志(欧盟监管标志)被接受进入英国市场,直到 2028 年或 2030 年,具体取决于设备的具体类型。18