XiaoMi-AI文件搜索系统
World File Search System人Rad52刺激RAD51介导的同源搜索
非小细胞肺癌经常在晚期诊断出来,许多患者仍接受经典化学疗法治疗。化学疗法的非选择性通常会导致严重的骨髓抑制。先前的研究表明,蛋白质编码突变无法完全解释骨髓压机的易感性。在这里,我们研究了增强子突变在骨髓抑制易感性中的可能作用。我们生成了三种用卡泊蛋白或吉西他滨处理的三种血管茎的转录组和启动子相互作用图(使用HICAP)。使用公开可用的增强剂数据集的优势,我们使用表观遗传学CRISPR技术验证了硅和活细胞中的HICAP。我们还开发了一种用于相互作用分析和检测差异相互作用基因的网络方法。差异相互作用分析提供了有关相关基因和骨髓抑制途径的其他信息,与散装水平的差异基因表达分析相比。此外,我们表明,与不同水平相关的骨髓抑制水平相关的变体,具有差异相互作用基因的增强子。中心,我们的工作代表了非编码突变的函数注释的整合转录组和基因调节数据集分析的一个突出例子。
AAVS的空间基因组学揭示了转录串扰的机制,该机制可以靶向大型遗传货物 DNA结构设计通过人工扩展的基本对(包括循环和不匹配热力学参数)进行改进 古代DNA揭示了阿尔巴尼亚人列昂尼达斯的起源... 在超低剂量分枝杆菌鼠模型中评估疫苗介导的保护 和人类特异性缺失的反式调节靶基因 人脑功能性子... 的同源景观 细胞穿透肽和阳离子脂质体介导的siRNA递送,以阻止慢性髓样白血病细胞在体外 在电影观看期间从童年到成年初观看时代和固定大脑连接性的个体差异:年龄,性别和行为协会
。cc-by-nc-nd 4.0国际许可证(未经同行评审证明)获得的是作者/资助者,他授予Biorxiv授予Biorxiv的许可,以永久显示预印本。这是该版本的版权持有人,该版本发布于2023年12月24日。 https://doi.org/10.1101/2023.12.23.573214 doi:Biorxiv Preprint
同源 Ad26.COV2.S 疫苗接种会导致混合免疫中体液反应增强减弱,但无论之前是否感染,都会引发类似强度的抗体
1 南非约翰内斯堡威特沃特斯兰德大学病理学院 SA MRC 抗体免疫研究组,2 南非约翰内斯堡国家卫生实验室服务国家传染病研究所 HIV 和 STI 中心,3 开普敦大学传染病和分子医学研究所,南非天文台,4 开普敦大学病理学系医学病毒学分部,南非天文台,5 开普敦大学医学系及 Groote Schuur 医院,南非天文台,6 开普敦大学健康科学学院开普心脏研究所;南非天文台,7 南非医学研究委员会非传染性疾病与传染病交叉研究外部单位,开普敦大学,开普敦,南非,8 南非医学研究委员会,开普敦,南非,9 南非艾滋病研究中心,德班,南非,10 夸祖鲁纳塔尔大学公共卫生医学学科,德班,南非,11 德斯蒙德图图艾滋病毒中心,开普敦,南非,12 开普敦大学惠康非洲传染病研究中心,天文台,南非
theranoticic生物标志物和PARP抑制剂在非BRCA相关的同源重组缺陷肿瘤的患者中的有效性:仍然通过肮脏的玻璃窗看?
提出了一种新的数值连续性一域方法(ODA)求解器,以模拟自由流体和多孔培养基之间的转移过程。求解器是在介观尺度框架中开发的,其中假定多孔介质的物理参数(例如孔隙率和渗透率)的连续变化。在不可压缩的流体的假设下,Navier -Stokes -Brinkman方程与连续性方程一起解决。假定多孔培养基已完全饱和,并且可能是各向异性的。该域被非结构化的网格离散,允许局部改进。应用了一个分数时间步骤过程,其中一个预测变量和两个校正步骤在每次迭代中求解。预测变量步骤在时空过程的框架内解决,具有一些重要的数值优势。两个校正器步骤需要大型线性系统的解决方案,该系统的矩阵稀疏,对称和正确定,在Delaunay -meshes上具有 -Matrix属性。使用预处理的共轭梯度方法获得快速有效的解决方案。两个校正器步骤所采用的离散化可以被视为两点 - 频率 - 及时(TPFA)方案,该方案与标准TPFA方案不同,该方案不需要网格网格的网状网格是𝐊-the-the-the-ottropropropy Tensor。如提供的测试用例所示,所提出的方案正确保留了多孔培养基中的各向异性效应。此外,它克服了文献中提出的现有介质量表的一域方法的限制。
胰腺癌同源重组修复缺陷的检测和治疗意义:叙述性综述
PDAC 肿瘤的基因组测序研究表明,高达 15% (4) 的肿瘤存在缺陷,由于 DNA 修复缺陷而导致基因组不稳定 (5)。DNA 修复途径对于保护细胞免受外源性和内源性 DNA 损伤至关重要。这些途径在癌细胞中经常出现功能障碍,导致 DNA 损伤积累和基因组不稳定 (6)。同源重组缺陷 (HRD) 是一种复杂而动态的肿瘤表型,其特征是无法通过同源重组修复 DNA 中的双链断裂 (DSB)。另一个高度保守的 DNA 修复过程是涉及单链 DNA 断裂的碱基切除修复途径。聚 (ADP-核糖) 聚合酶 (PARP) 酶是该途径的关键元素。约 5–8% 的 PDAC 与 BRCA1/2 致病性种系变异有关,导致 BRCA 功能缺陷,因此更依赖 PARP 进行 DNA 修复;如果这些患者对含铂化疗的一线治疗有反应,他们可以从 PARP 抑制剂的维持治疗中受益 (7)。在此,我们根据叙述性综述报告清单(可访问 https://jgo.amegroups.com/article/view/10.21037/jgo-23-85/rc)对 PDAC 中的 HRD 进行了综述。
含有驱动蛋白的calponin同源域,KIS1调节叶绿体的形成和免疫力
叶绿体形态在免疫期间发生变化,从而产生了称为stromules的小管状结构。stromules沿着微管延伸,并沿核细胞锚定向肌动蛋白丝,以促进核周chlo-oplast簇。这促进了防御分子/蛋白质从叶绿体到核的运输。缺乏茎在免疫中的直接作用的证据,因为目前,没有已知的基因来调节Stromule生物发生。我们表明,在TNL [TIR(Toll/Interleukin-1 Receptor) - 型链球菌形成所必需的含有驱动蛋白的Calponin同源(CH)结构域(诱导Stromules 1)所需的calponin同源(CH)域(诱导Stromules 1)是必需的。此外,tnl介导的对细菌和病毒病原体的免疫力是必需的。基斯1的微管结合运动结构域是基质形成所必需的,而肌动蛋白结合,CH结构域是核叶叶绿体簇需要的。我们表明,KIS1通过早期的免疫信号成分EDS1和PAD4与水杨酸 - 需要Kis1的stromules发挥作用。因此,KIS1代表stromule生物发生的玩家。
利用同源性独立的 CRISPR–Cas9 精准基因组编辑快速高效生成敲入人类类器官
类器官可通过诱导多能干细胞和胚胎干细胞的引导分化生成,也可从从成体组织中分离的细胞生成 1 。成体干细胞 (ASC) 衍生的类器官是自组织结构,可重现其来源的不同上皮组织的细胞组成、三维 (3D) 结构和功能的各个方面,同时保持基因组稳定性 2、3 。从转基因小鼠品系(尤其是敲入模型)中获得类器官的可能性使得能够生成工程化小鼠类器官,这些类器官已被用作多功能体外工具来回答各种生物学问题 4 3 10 。生成工程化人类 ASC 衍生类器官需要在建立品系后应用有效的体外基因组编辑策略。CRISPR3Cas9 技术大大简化了基因工程。迄今为止,这些方法主要限于非同源末端连接 (NHEJ) 介导的将插入/缺失引入类器官内源性基因座,从而导致基因突变 11 3 14 。通过利用 HDR 通路,引入单碱基替换来纠正囊性纤维化肠道类器官中的 CFTR 基因座 15 ,并且已经生成了一些人类 ASC 类器官敲入报告系,但主要是在结肠癌类器官中 16 3 18 。使用 HDR 的敲入利用了细胞修复双链断裂 (DSB) 的机制。可以使用 CRISPR3Cas9 在特定位点引入此类断裂。HDR 是用于靶向插入的最常用方法,但该过程效率低下并且要求细胞处于 S 期 19,20 。此外,HDR 需要克隆供体质粒,因为需要存在每个基因特有的同源臂(图 1a)。最近的研究表明,CRISPR 诱导的 DSB 可激活
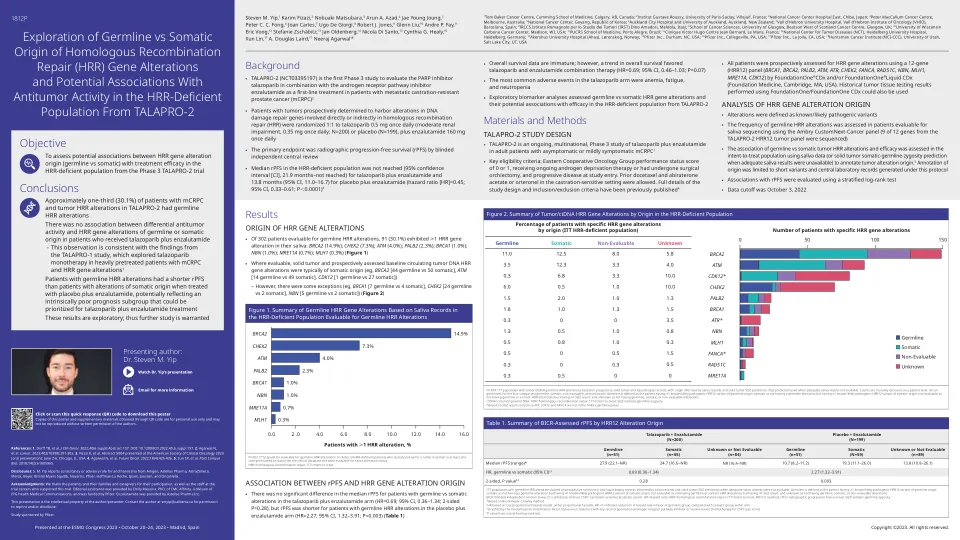
探索种系与同源重组的躯体起源
1汤姆·贝克癌症中心,卡明医学院,加拿大卡尔加里; 2法国维勒维夫大学,巴黎 - 萨克莱大学的Gustave Roussy研究所;日本千叶北部国家癌症中心医院3;澳大利亚墨尔本市彼得·麦卡伦(Peter MacCallum Cancer Center)4; 5号国家癌症中心,大韩民国戈阳; 6奥克兰市医院和奥克兰大学,新西兰奥克兰;西班牙巴塞罗那市Vall d'Hebron肿瘤学研究所(VHIO)Vall D'Hebron大学医院7; 8 Irccs iStituto romagnolo per lo Studio dei tumori(Irst)Dino Amadori,意大利梅尔多拉; 9英国格拉斯哥的苏格兰癌症中心的Beatson,格拉斯哥大学癌症科学学院9;威斯康星州麦迪逊市威斯康星州麦迪逊市威斯康星大学10号; 11 PUCRS医学院,巴西Porto Alegre; 12 Clinique Victor Hugo Center Jean Bernard,法国勒芒; 13德国海德堡海德堡大学医院国家肿瘤疾病中心(NCT);挪威洛伦斯科格(Lørenskog)14 Akershus大学医院(Ahus); 15美国北卡罗来纳州达勒姆市Pfizer Inc.; 16美国宾夕法尼亚州大学维尔市Pfizer Inc.; 17 Pfizer Inc.,美国加利福尼亚州拉霍亚; 18犹他大学,犹他州盐湖城,美国犹他州,亨斯曼癌症研究所(NCI-CCC)
同源修复模板 DNA 链间交联增强人类细胞中的基因编辑
CRISPR–Cas9 通过产生 DNA 双链断裂 (DSB) 并随后激活细胞 DNA 修复途径实现基因编辑。根据所参与的修复途径,结果可能包括目标基因的破坏或用恢复或引入功能的新序列替换 1 。后一种基因替换事件需要传递编码新序列的模板 DNA,其水平应支持基因替换,但不会对细胞活力产生不利影响。在转化应用中,模板分子通常由病毒载体递送。虽然有效,但病毒工作流程成本高昂、难以扩大规模且对细胞有潜在毒性。因此,使用非病毒模板 DNA 是一种有吸引力的替代方案,但非病毒模板的效率和急性毒性可能不如病毒递送 2 。改进的非病毒基因编辑将成为揭示 DNA 修复机制的有力方法、有用的实验室技术和治疗多种疾病的有前途的策略 3 。一种高效的非病毒基因编辑策略是传递核糖核蛋白(RNP)制剂,包括靶向核酸酶Cas9、单向导RNA(sgRNA)和模板分子,该模板分子包含与被编辑区域以及要修改或插入的序列的同源性4。这些RNP在基因组的目标区域引入DSB,然后通过易错末端连接(EJ)过程修复断裂末端,或通过同源性定向修复(HDR)过程修复DSB,该过程使用单独模板分子1中编码的序列解决DSB(扩展数据图1a)。使用HDR将新的DNA序列引入目标位置可以实现令人兴奋的功能获得应用5。因此,增加HDR频率的策略可能会改善结果并降低实验室和生物医学工作流程的成本。
CRISPR-CAS9直接融合,以改进基因组编辑,通过增强的同源重组
基因编辑是一种尖端技术,正在迅速重塑生物技术,医学和农业学科。遗传构成的精确改变需要在感兴趣的区域引入DNA病变,并利用DNA损伤响应和同源驱动的修复机制。DNA容易受到各种生理和病理因素的每日损害[1],导致DNA双链断裂(DSB)或单链断裂(SSB或Nick)可能会触发基因组恢复,如果未经修复或不正确地修复时[2]。这些事件可以触发下游过程,例如致癌或程序性细胞死亡[3]。为维持基因组完整性,维修机制网络已经发展,它们的激活是由内源性或外源性应激引起的DNA损伤类型决定的。基因编辑技术利用了此内在修复网络的功能来重写DNA。四个主要的编辑平台包括巨型核酸酶,锌纤维核酸酶(ZFN),转录激活剂样效应核酸酶(TALENS)和定期插入的短短圆锥形重复序列(CRISPR)。天然巨核触发了DNA损伤,但需要独特的识别序列才能进行动作,这使得很难找到目标区域特异性的endonucle-Ases [4]。重新设计核酸酶的努力导致了替代方案的发展,例如ZFNS和TALES,其中DNA结合结构融合到了FOKI限制酶的裂解结构域。这种大大改善了人类细胞和动物模型中的基因编辑,从而促进了基因编辑的治疗应用[5-8]。然而,可行性问题仍然无法解决,因为这些人工核酸酶除了随机的脱靶诱变外,还需要蛋白质工程的目标序列,这使整个过程中的目标序列的每一个变化都使整个过程都易于努力且昂贵[9]。包装和大型核酸酶的包装和交付也很困难,进一步限制了体内应用[7]。另一方面,CRISPR技术在编辑方式上具有非常重要的优势,因为它克服了每个新目标站点对蛋白质工程的需求,从而使其易于重编程[4]。但是,由于CRISPR会产生非专业的DSB,可以介绍 -