XiaoMi-AI文件搜索系统
World File Search System鉴定具有大量平行筛选的高效和组织特异性启动子
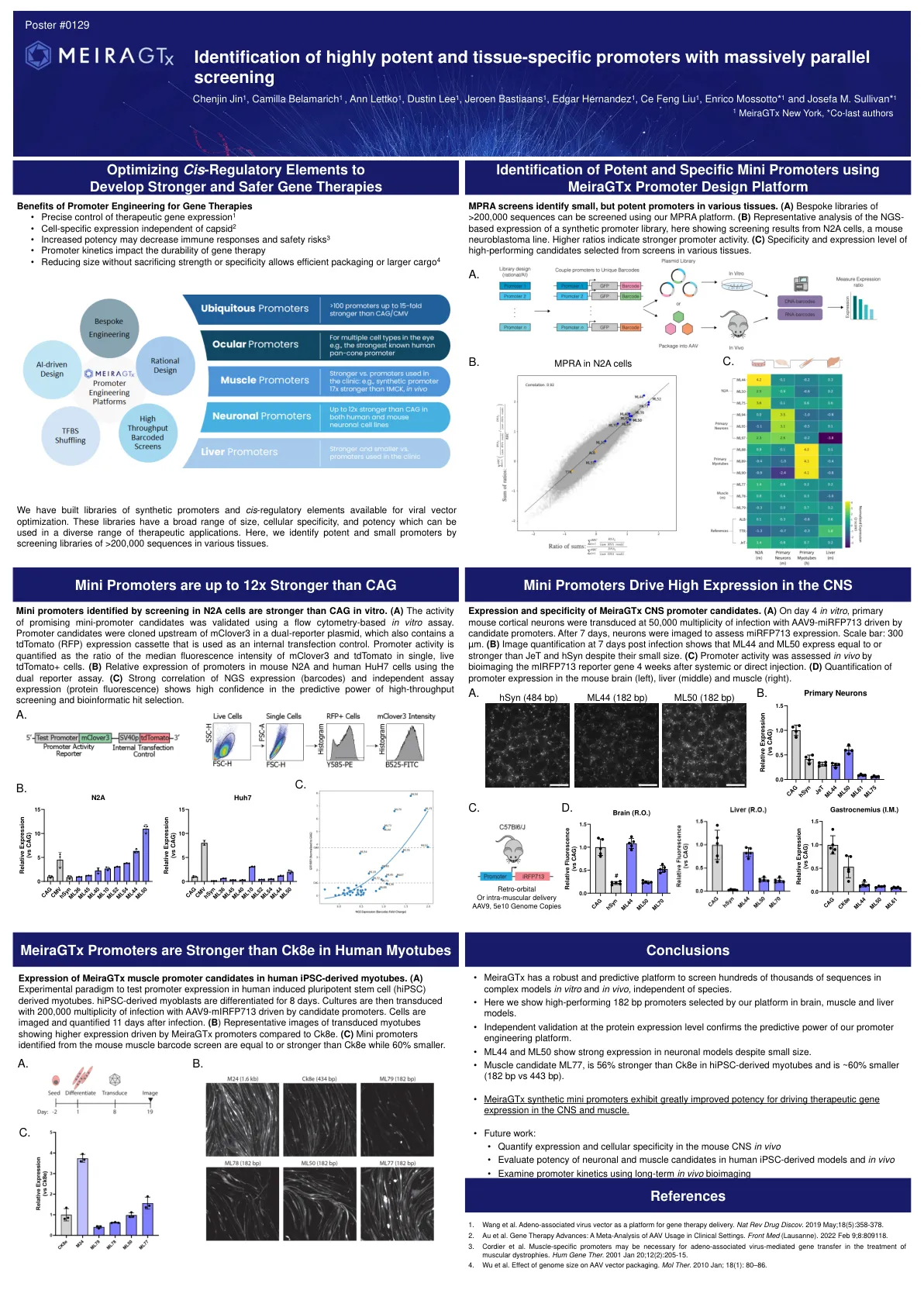
迷你启动子在体外比CAG强。(a)使用基于流式细胞术的体外测定法对有希望的迷你启动候选者的活性进行了验证。启动子候选物被克隆在双重孢子质粒中的McLover3上游,该质粒还包含TDTOMATO(RFP)表达盒,该盒被用作内部转染对照。启动子活性被量化为单个活的TDTOMATO+细胞中McLover3和TDTomato的中位荧光强度的比率。(b)使用双报告基因测定法分析,启动子在小鼠N2a和人HuH7细胞中的相对表达。(c)NGS表达(条形码)和独立测定表达(蛋白质荧光)的强相关性表现出对高通量筛选和生物信息学命中选择的预测能力的高信心。
crispr删除SVA逆转录座子在TRPV1/TRPV3属基因间区域的顺式调节元件
摘要:正弦 - vntr- Alu(SVA)逆转录子是仅在灵长类动物基因组中存在的可转座元素(TES)的子类。te插入可以作为顺式调节元素(CRES)选择;但是,使用生物信息学方法和报告基因测定法证明了SVA的调节潜力。这项研究的目的是证明通过CRISPR(群集间隔间隔短的腔粒重复序列)的SVA顺式调节活性),并随后测量直接对局部基因表达的影响。我们识别了17染色体上的一个区域,该区域富含人类特异性SVA。在该区域的比较基因表达分析揭示了多个人体组织中TRPV1和TRPV3的共表达,这在小鼠中未观察到,这突出了两种物种之间的关键调节差异。此外,TRPV1和TRPV3编码序列之间的基因间区域包含位于TRPV3启动子和TRPV1 3'端的上游的人类特定的SVA插入,该插入trpv1的3'端,强调了该SVA作为研究其潜在的CIS -CIS-候选者对这两种基因的候选者。首先,我们生成了SVA报告基因构建体,并证明了它们在HEK293细胞中的转录调节活性。然后,我们设计了一种双目标CRISPR策略,以促进整个SVA序列的删除,并生成编辑的HEK293克隆细胞系,其中包含纯合和杂合SVA缺失。在编辑的纯合∆ SVA克隆中,我们观察到TRPV1和TRPV3 mRNA表达的显着降低,与未经编辑的HEK293相比。此外,我们还观察到杂合∆ SVA克隆中mRNA表达水平的变异性增加。总体而言,在具有SVA缺失的编辑的HEK293中,我们观察到对TRPV1和TRPV3的共表达的中断。在这里,我们提供了人类特异性SVA的示例,其原位调节活性,支持SVA逆转座子的作用,是物种特异性基因表达的贡献者。
在工程人类巨噬细胞中缺氧诱导的慢病毒基因表达
抽象背景人类免疫细胞,包括单核细胞衍生的巨噬细胞,可以设计用于提供促炎性细胞因子,双特异性抗体和嵌合抗原受体,以支持不同疾病环境中的免疫反应。当基因表达受组成型活性启动子调节时,慢病毒有效载荷基因表达不受管制,并且可能导致潜在的毒素含量。慢病毒编码蛋白的调节递送可能允许局部或有条件的治疗蛋白表达,以支持安全传递的,具有降低全身毒性能力的传递转移的转基因细胞。在这项研究中,我们设计了人类巨噬细胞,以表达慢病毒启动子区域中的缺氧反应元件调节的基因,以驱动仅在低氧条件下驱动有条件的慢病毒基因表达。我们测试了在缺氧条件下培养的转导的巨噬细胞,用于瞬时诱导的报告基因的表达和分泌的细胞因子Interleukin-12。在切片培养系统中,在转录和翻译中都研究了低氧调节基因的表达。最后,在皮下人性化小鼠癌症模型中评估了缺氧调节的基因表达。结果的巨噬细胞显示出有条件的和三局的慢病毒编码基因蛋白产物,包括在体外缺氧条件下IL-12。返回到常氧条件后,慢病毒有效载荷表达式返回到基础水平。报告基因在缺氧条件下上调,这表明对癌症中局部基因递送的全身工程细胞递送的实用性。结论是为表达缺氧调节的有效载荷设计的巨噬细胞的潜力,有可能在患有缺氧条件的组织中系统地和有条件地表达蛋白质。与在缺氧条件下起作用或生存不佳的免疫细胞相反,巨噬细胞保持促炎的表型,当通过条件性缺氧反应性元素调节并自然访问低氧微型环境时,可能支持持续的基因和蛋白质表达
优化的 HDR 介导的 K-荧光蛋白敲入...
图 2:在 K-562 细胞中通过电穿孔优化 HDR 介导的报告基因敲入。A. LMNA -EGFP 供体质粒单独电穿孔,浓度增加,显示非特异性 EGFP 表达量较低。Cas9 蛋白:crRNA:tracrRNA 电穿孔,LMNA -EGFP 供体质粒浓度增加,显示 EGFP 表达相关增加。B. 放大倍数增加后,HDR 介导的敲入样本中 EGFP 表达的定位与 LMNA 的预期一致,位于细胞核中,并与 Hoechst 染色共定位。C. HDR 介导的敲入细胞群的流式细胞术分析显示,随着 DNA 供体质粒数量的增加,EGFP 表达增加高达 32%。单独 DNA 供体质粒对照的相应分析显示所有剂量的 EGFP 表达均低于 0.5%(未显示数据)。
基因组编辑的进展及其在转基因大鼠模型生成中的应用
大鼠被广泛用作小动物模型。过去二十年出现了许多基因工程大鼠模型,近年来基因特异性核酸酶的出现加速了它们的产生。本综述涵盖了用于产生基因工程大鼠品系的技术和进展,以及它们在更广泛地开发大鼠模型中的应用,例如条件性敲除和报告基因品系。此外,还讨论了尚待在大鼠中探索的基因组编辑技术。本综述还特别关注了已经进行了大量研究的两个领域:人类遗传疾病和免疫系统分析。在这两个领域中对模型进行了详细描述,并强调了大鼠模型相对于现有的相应小鼠模型的竞争优势。本综述的目的是全面描述大鼠模型在解决特定科学问题方面的优势和潜力,并描述用于开发新项目的最佳基因组工程工具。
使用笼子乙基雌二醇和诱导的Cre/Lox系统迈向眼睛的光介导的基因疗法
摘要:越来越多地,正在用病毒介导的基因疗法治疗视网膜病理。能够以光特定针对视网膜病理区域的病毒转基因表达,我们确定了视网膜组织的体内光活化基因表达para-digm。基于诱导型Cre/Lox系统,我们发现乙基雌二醇是他莫昔芬的合适替代品,因为乙基雌二醇更适合通过光敏保护化合物(即“笼子”)修饰。在计算机结合研究中支持了突变的人雌二醇受体的乙基甲基二醇作为配体的鉴定,该研究表明笼中乙基雌二醇的结合降低。用依赖性的TDTOMATO报告基因转基因注入双转基因GFAP-CREERT2小鼠的眼睛中,然后用450 nm的光照射。光活化显着增加了视网膜TDTOMATO表达。因此,我们展示了为眼睛开发靶向的,光介导的基因治疗的第一步。
斑马鱼药物筛选证实厄洛替尼是 T 细胞急性淋巴细胞白血病中 Wnt/β-Catenin 信号和自我更新的抑制剂
图 1:6xTCF/LEF-miniP:GFP 斑马鱼系对 Wnt 信号通路的小分子调节剂产生可量化的反应。(A) Wnt/β-catenin GFP 报告基因 6xTCF/LEF-miniP:dGFP 转基因斑马鱼系的示意图。(B) 受精后 48 小时 (hpf) 的 6xTCF/LEF-miniP:dGFP 斑马鱼幼虫。GFP 荧光表明 Wnt 信号活跃,尾鳍 (虚线框) 用于量化。(C) 用 DMSO、Wnt 通路抑制剂 XAV939 或 Wnt 通路激活剂 BIO 处理 24 小时的 6xTCF/LEF- miniP:dGFP 幼虫中的代表性尾鳍荧光。从左到右的面板显示了明场图像、GFP 荧光和使用 ImageJ 软件对荧光进行标准化阈值处理。图中标出了与 DMSO 相比荧光增加或减少的百分比。比例尺 = 500 μm。
通过DNA-PKCS的药理延迟增强CRISPR删除
CRISPR-CAS9缺失(CRISPR-DEL)是消除哺乳动物细胞中DNA的领先方法,并为各种基因组编辑的应用提供了基础。靶DNA在非同源最终连接(NHEJ)期间由一对双链断裂(DSB)定义。但是,CRISPR-DEL的低效率导致了费力的实验和错误的负面结果。通过使用内源性报告基因系统,我们表明DNA依赖性蛋白激酶催化亚基(DNA-PKC)的抑制作用(NHEJ的早期一步)会大大增加DNA缺失。这是在各种细胞系,基因递送方法,商业抑制剂和引导RNA中观察到的,包括那些表现出可忽略的活性的RNA。我们进一步表明,DNA-PKCS抑制作用可用于提高合并功能屏幕的灵敏度,并检测否则会忽略的真实阳性命中。因此,延迟NHEJ相对于DSB形成的动力学是增强CRISPR损坏的一种简单有效的手段。
转基因植物(检测
PCR方法是增加想要检查的基因或区域的量,依靠DNA中的双基碱基捕获DNA的新DNS开始是由DNA设计的短DNS或底漆(底漆)。在该基因或我们要检查基因顶部DNA的区域上可能是启动子上的位置。 Terpector or genes selected (Table 1) Table 1 Marker and Reporter Gene Transfer in Plant Gene Enzyme/Protein Encoded Antibiotic Resistance Dihydrofolalate Reductase Methotrexate Resistant Cat Chloramphenicol Acetyltransferase Chloramphenicol Resistant NPTII NOMYCIN PHOTRANFERSE KANAMYCIN RESISTANT AROSISTANT AROVVY Shihimate-3-磷酸合酶草甘膦抗性报告基因CAT CAT氯霉素乙酰基转移酶GUSβ-葡萄糖醛酸糖苷酶诺巴胺合酶Lucifa-Galasse glep glep grep grep grep grep grep grep geel geel fluorescence geel fluorescent div>
生成基因工程动物模型的新方法
转基因依赖于使用大型复杂的表达载体,在病毒或组织特异性哺乳动物启动子的控制下,通过显微注射将载体递送到原核阶段受精卵中,从而指导互补 DNA (cDNA) 的表达(图 1)。虽然这种方法提供了一种粗略但有效的方法来设计表达报告基因、基因突变形式和条件调控基因的动物模型,但它不能用于精确修改内源基因。此外,转基因在小鼠基因组内的整合是随机发生的,整合位点的位置以及整合的次数可能会影响转基因的表达。此外,如果转基因整合破坏了基因或转录调控元件,整合位点本身可能会诱导其自身的表型。由于转基因整合位点和转基因整合次数可能因小鼠而异,因此需要扩展多个创始者并检查转基因表达水平和由此产生的表型 [1]。