XiaoMi-AI文件搜索系统
World File Search System开放纳米医学和纳米技术期刊
目前针对癌症的疗法收效甚微。纳米技术是一种很有前途的癌症追踪、诊断和治疗方法。混合纳米技术将多种材料组装成多模态系统,以开发出多功能癌症治疗方法。量子点和聚合物就是这些混合纳米粒子平台中的一些。量子点混合系统具有光子和磁性,可实现光热疗法和癌症的实时多模态成像。这些量子点用于将药物输送到癌细胞。混合聚合物纳米粒子用于将小干扰 RNA 系统性地输送到恶性肿瘤和转移灶。它们允许非侵入性成像实时追踪全身小干扰 RNA 的生物分布。它们提供了通过特异性沉默靶基因来治疗癌症的机会。本综述重点介绍了有效治疗癌症和转移的主要纳米技术方法。
cap-004-icar-poster-final.pdf
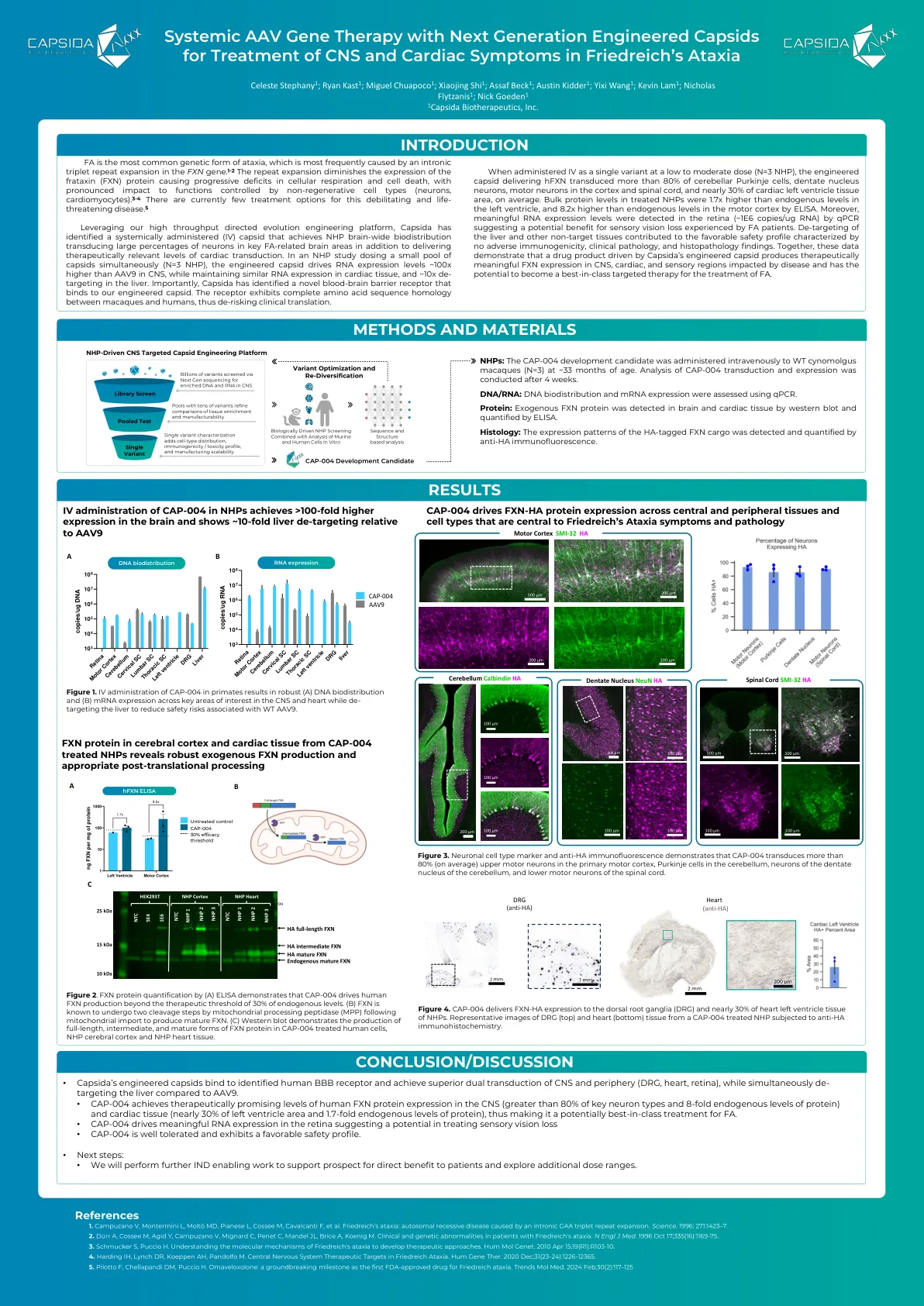
利用我们高通量的定向进化工程平台,Capsida确定了一个系统地给药的(IV)Capsid,该capsID可实现NHP脑范围的生物分布,除了提供治疗相关的心脏转移水平外,还可以在关键FA相关的大脑区域中转导大量的神经元。在NHP研究中,同时给予一小片capsID(n = 3 NHP),工程化的衣壳驱动的RNA表达水平比CNS中的AAV9高约100倍,同时在心脏组织中保持相似的RNA表达,并且在肝脏中降低了约10x。重要的是,Capsida已经确定了一种与我们工程化的衣壳结合的新型血脑屏障受体。受体在猕猴和人类之间表现出完整的氨基酸序列同源性,从而使临床翻译变得过时。
和177LU-PSMA-617在前列腺癌的鼠模型中
靶向前列腺特异性膜抗原(PSMA)的放射性核素治疗是转移性cast割的疾病癌的有前途的选择。使用177 lu或225 AC的临床经验具有令人鼓舞的治疗反应;但是,响应不耐用。双同位素组合或“串联”方法可以提高耐受性,同时保持高肿瘤剂量。在这项研究中,我们直接比较了疾病的不同阶段的A-与B粒子治疗以及其组合,在鼠类散布的前列腺癌模型中。方法:首先,要确定177 lu-和225 AC-PSMA-617的可比注射活性,在治疗C4-2皮下肿瘤后的5个时刻进行了离体生物分布研究 - 带有NSG小鼠。为转移性前列腺癌的更具代表性的模型,NSG小鼠在左心室中用表达荧光素酶的C4-2细胞接种了NSG小鼠,从而导致了分布的内脏和骨骼病变。接种后3或5周,单独或组合使用等效肿瘤剂量 - 沉积177 Lu-或225 AC-PSMA-617的活性(35 MBQ为177 LU,40 KBQ,225 AC的40 KBQ,或177 Lu 1 20 KBQ 225 kbq 225 AC; 10/Group; 10/Group; 10/Group)。通过每周生物发光成像评估疾病负担。 使用全身肿瘤负担和总体存活率评估了治疗效率。 结果:离体生物分布研究表明,皮下C4-2模型中的35 MBQ为177 LU和40 kBQ,为225 AC产量的吸收性肿瘤剂量。通过每周生物发光成像评估疾病负担。使用全身肿瘤负担和总体存活率评估了治疗效率。结果:离体生物分布研究表明,皮下C4-2模型中的35 MBQ为177 LU和40 kBQ,为225 AC产量的吸收性肿瘤剂量。接种(177 LU的微观疾病)在3周治疗的小鼠的疾病负担与未治疗的小鼠的疾病没有显着差异。但是,225个AC-PSMA-617都是单一药物,并与177 Lu(177 MBQ的177 Lu 1 20 kBQ 225 ac)相关联,全身肿瘤的增长延迟和生存率显着,无效的是17.4 WK,14.4 wk and 14.3 WK,14.3 WK,15.3 WK,14.3 WK串联疗法)。在接种后5周(宏观疾病)进行治疗时,所有治疗组均显示肿瘤的生长和生存率提高,仅225 AC和给药之间没有显着差异,而在177 LU中伴有225 AC活性的一半是177 LU的225个AC活性(整体存活率为7.9 wk,用于1.3 wk for 177 Lu,14.6 wk,14.6 Wk,14.6 Wk,wk,14.6 Wk,wk,wk wk,wk wk,wk wk and 225 wk,wk wk and 225 wk wk wk and 225 wk。 治疗)。结论:与177 LU相比,同时使用225 AC-和177 LU-PSMA-617的前列腺癌模型的处理显着降低了肿瘤的生长,这显着降低了,这是对
jnumed.124.267416.full.pdf
尽管前列腺癌治疗领域已包含多种药物,但仍需要新的治疗方案来满足转移性去势抵抗性前列腺癌 (mCRPC) 患者尚未满足的需求。尽管前列腺特异性膜抗原是唯一对晚期前列腺癌男性产生临床益处的细胞表面靶点,但其他靶点可能会进一步促进针对这些患者的免疫、细胞毒性、放射性药物和其他肿瘤导向疗法。人激肽释放酶 2 (hK2) 是一种新型前列腺特异性靶点,在非前列腺组织中几乎没有表达。这项首次人体 0 期试验使用 111 In 放射性标记的抗 hK2 单克隆抗体 [ 111 In]-DOTA-h11B6,证实 hK2 是前列腺癌治疗的潜在靶点。方法:患有进行性 mCRPC 的参与者单次输注 2 mg [ 111 In]-DOTA-h11B6(185 MBq 111 In),同时输注或不输注 8 mg 未标记的 h11B6,以评估抗体质量效应。采集连续成像和连续血样,以确定 [ 111 In]-DOTA-h11B6 的生物分布、剂量、血清放射性和药代动力学。在 [ 111 In]-DOTA-h11B6 给药后的 2 周随访期内评估安全性。结果:22 名参与者接受了 [ 111 In]-DOTA-h11B6 治疗,并纳入本次分析。给药后 6 – 8 天内,[ 111 In]-DOTA-h11B6 在已知的 mCRPC 病变中明显蓄积,而其他器官的摄取有限。发生了两起与治疗无关的治疗引起的不良事件,包括 1 名患者的肿瘤相关出血,这导致研究提前终止。血清清除率、生物分布和肿瘤靶向性与总抗体质量(2 或 10 毫克)无关。结论:这项首次人体研究表明,可以使用 h11B6 作为平台识别和靶向肿瘤相关的 hK2,因为 h11B6 抗体选择性地在 mCRPC 转移中积累,具有与质量无关的清除动力学。这些数据支持 hK2 作为成像靶标和 hK2 靶向药物作为 mCRPC 患者潜在疗法的可行性。
和LU-PSMA-617在前列腺癌的鼠模型中
靶向前列腺特异性膜抗原(PSMA)的放射性核素治疗是转移性cast割的疾病癌的有前途的选择。使用177 lu或225 AC的临床经验具有令人鼓舞的治疗反应;但是,响应不耐用。双同位素组合或“串联”方法可以提高耐受性,同时保持高肿瘤剂量。在这项研究中,我们直接比较了疾病的不同阶段的A-与B粒子治疗以及其组合,在鼠类散布的前列腺癌模型中。方法:首先,要确定177 lu-和225 AC-PSMA-617的可比注射活性,在治疗C4-2皮下肿瘤后的5个时刻进行了离体生物分布研究 - 带有NSG小鼠。为转移性前列腺癌的更具代表性的模型,NSG小鼠在左心室中用表达荧光素酶的C4-2细胞接种了NSG小鼠,从而导致了分布的内脏和骨骼病变。接种后3或5周,单独或组合使用等效肿瘤剂量 - 沉积177 Lu-或225 AC-PSMA-617的活性(35 MBQ为177 LU,40 KBQ,225 AC的40 KBQ,或177 Lu 1 20 KBQ 225 kbq 225 AC; 10/Group; 10/Group; 10/Group)。通过每周生物发光成像评估疾病负担。 使用全身肿瘤负担和总体存活率评估了治疗效率。 结果:离体生物分布研究表明,皮下C4-2模型中的35 MBQ为177 LU和40 kBQ,为225 AC产量的吸收性肿瘤剂量。通过每周生物发光成像评估疾病负担。使用全身肿瘤负担和总体存活率评估了治疗效率。结果:离体生物分布研究表明,皮下C4-2模型中的35 MBQ为177 LU和40 kBQ,为225 AC产量的吸收性肿瘤剂量。接种(177 LU的微观疾病)在3周治疗的小鼠的疾病负担与未治疗的小鼠的疾病没有显着差异。但是,225个AC-PSMA-617都是单一药物,并与177 Lu(177 MBQ的177 Lu 1 20 kBQ 225 ac)相关联,全身肿瘤的增长延迟和生存率显着,无效的是17.4 WK,14.4 wk and 14.3 WK,14.3 WK,15.3 WK,14.3 WK串联疗法)。在接种后5周(宏观疾病)进行治疗时,所有治疗组均显示肿瘤的生长和生存率提高,仅225 AC和给药之间没有显着差异,而在177 LU中伴有225 AC活性的一半是177 LU的225个AC活性(整体存活率为7.9 wk,用于1.3 wk for 177 Lu,14.6 wk,14.6 Wk,14.6 Wk,wk,14.6 Wk,wk,wk wk,wk wk,wk wk and 225 wk,wk wk and 225 wk wk wk and 225 wk。 治疗)。结论:与177 LU相比,同时使用225 AC-和177 LU-PSMA-617的前列腺癌模型的处理显着降低了肿瘤的生长,这显着降低了,这是对
碳硼烷在硼中子俘获疗法 (BNCT) 中的体内应用:结构、配方和检测分析方法
摘要:碳硼烷已成为硼中子俘获疗法 (BNCT) 中最有前途的硼剂之一。在此背景下,体内研究尤为重要,因为它们提供了有关这些分子生物分布的定性和定量信息,这对于确定 BNCT 的有效性、确定其定位和(生物)积累以及其药代动力学和药效学至关重要。首先,我们收集了用于体内研究的碳硼烷的详细列表,考虑了碳硼烷衍生物的合成或使用脂质体、胶束和纳米颗粒等递送系统。然后,确定了每项研究中采用的配方和癌症模型。最后,我们研究了与碳硼烷检测有关的分析方面,确定了文献中用于离体和体内分析的主要方法。本研究旨在确定碳硼烷在 BNCT 中使用现状和缺点,确定未来应用的瓶颈和最佳策略。
纳米医学的大脑安全问题:需要特定的监管框架
1 EA 4446 Bioactive Molecules and Medicinal Chemistry, SFR Santé Lyon-Est CNRS UMS3453 - INSERM US7, Université Claude Bernard Lyon 1, Univ Lyon, Lyon, 69373, France 2 Small Molecules for Biological Targets Team, Centre de Recherche en Cancérologie de Lyon, Centre Léon Bérard, CNRS 5286,INSERM 1052,克劳德·伯纳德·里昂1号,里昂,里昂,69373,法国,通讯作者:Le Borgne,M。(Marc.le-borgne@uni-lyon1.fr)新的治疗实体; mRNA疫苗;纳米载体; BBB穿越;蛋白电晕;毒性;监管框架; fda; EMA预告片:近几个月来已授权mRNA-脂质纳米颗粒疫苗。这些纳米药物可以在体内发生一种称为蛋白电晕的现象,这可能会影响其生物分布。评估其大脑毒性的当前法规仍然有限。
利用超声波改变阿霉素的化学结构和生物纳米活性以选择性杀死癌细胞
纳米药物通常结合了活性治疗剂和纳米载体的功能,以控制药物在肿瘤中的药代动力学、生物分布和细胞靶向性,同时限制药物在健康组织中的细胞毒性作用。[1] 无论是新药还是纳米药物,从计算机设计到临床试验的开发,仍然具有挑战性、耗时长且成本高昂,新治疗剂能否进入市场并最终使患者受益存在很大的不确定性。[2] 大多数临床试验中或已获准使用的化疗纳米药物都是基于脂质或胶束配方,并结合了标准的非专利抗癌药物,如阿霉素 (DOX)、伊立替康、紫杉醇和顺铂。[3] 先进而复杂的纳米载体,如基于碳和聚合物的纳米颗粒、介孔无机材料、金属有机骨架以及 DNA 和
受监管的生物分析实验室中 qPCR 和 dPCR 验证的最佳实践
摘要。随着基因和细胞治疗产品数量的不断增加,分子技术在生物分析实验室中的应用也变得越来越普遍。目前,这些技术尚无生物分析监管指南,合同研究组织依赖科学判断和最佳实践来执行这项工作,以符合 GxP 要求,用于支持生物分布和载体脱落的临床前和临床研究。本文介绍了定量聚合酶链反应 (qPCR) 和数字 PCR (dPCR) 检测的开发和验证过程和原理,如 2021 年 AAPS 为期两天的 qPCR 协调研讨会上所述。本文的范围包括利用这些技术的生物分析验证参数和验收标准。此外,本文还将重点介绍这些分子技术的优缺点,并说明应避免的常见陷阱。本文旨在提供最佳实践、工作建议和促进未来的监管指导。
草酸铁钾纳米粒子可在小鼠模型中预防人体血液凝固和血栓形成
摘要:血凝块会堵塞静脉和动脉,从而产生有害影响。本文展示了人血中钾铁草酸盐纳米粒子 (KFeOx- NPs) 的抗凝特性,可用于血凝块管理。该机制涉及 KFeOx-NPs 中存在的草酸盐与血液中的钙离子螯合。我们使用各种商业化验来确定 KFeOx-NPs 的凝血时间,并确定内在途径中激活因子 XII 的障碍。我们使用动物模型来展示毒性和生物分布特征,并确定安全性和有效性。超声和能量多普勒图像证实,静脉注射 KFeOx-NPs 可增加小鼠模型的凝血时间和血栓预防。用 KFeOx-NPs 涂覆导管可防止血凝块形成,与血液一起孵育时蛋白质附着减少,从而增强血流特性。在生物应用中,KFeOx-NPs可以改善对血栓形成的长期预防并提高医疗设备的效率。