XiaoMi-AI文件搜索系统
World File Search System主题:α1-蛋白酶抑制剂(人)
AAT的缺乏是一种常染色体,共同主导的遗传疾病,本身不是一种疾病,而是疾病后期发展的倾向。 AAT的低血清水平与其他遗传确定的特征和环境影响,导致疾病状态的发展(例如,肺)。 流行病学研究的证据表明,在肺似乎受到保护的血清阈值水平以上。 血清阈值水平在11个微孔中,约占平均正常水平的35%。 已经确定了30多种遗传变异,导致AAT水平不足。 最常见的等位基因称为M;大多数人具有蛋白质表型Pi*mm。 AAT基因型赋予患肺部疾病风险增加的风险增加的基因型是那些缺乏或无效等位基因(在纯合或杂合状态下)编码AAT水平以下的AAT水平低于保护阈值的缺乏或无效等位基因。 无效等位基因(指定为Pi Qoqo)与最严重的缺陷相关,没有产生活性AAT,或者少于正常量的血浆AAT的1%。 最常见的AAT等位基因是Z变体和Pi*Zz 的个人AAT的缺乏是一种常染色体,共同主导的遗传疾病,本身不是一种疾病,而是疾病后期发展的倾向。AAT的低血清水平与其他遗传确定的特征和环境影响,导致疾病状态的发展(例如,肺)。 流行病学研究的证据表明,在肺似乎受到保护的血清阈值水平以上。 血清阈值水平在11个微孔中,约占平均正常水平的35%。 已经确定了30多种遗传变异,导致AAT水平不足。 最常见的等位基因称为M;大多数人具有蛋白质表型Pi*mm。 AAT基因型赋予患肺部疾病风险增加的风险增加的基因型是那些缺乏或无效等位基因(在纯合或杂合状态下)编码AAT水平以下的AAT水平低于保护阈值的缺乏或无效等位基因。 无效等位基因(指定为Pi Qoqo)与最严重的缺陷相关,没有产生活性AAT,或者少于正常量的血浆AAT的1%。 最常见的AAT等位基因是Z变体和Pi*Zz 的个人AAT的低血清水平与其他遗传确定的特征和环境影响,导致疾病状态的发展(例如,肺)。流行病学研究的证据表明,在肺似乎受到保护的血清阈值水平以上。血清阈值水平在11个微孔中,约占平均正常水平的35%。已经确定了30多种遗传变异,导致AAT水平不足。最常见的等位基因称为M;大多数人具有蛋白质表型Pi*mm。AAT基因型赋予患肺部疾病风险增加的风险增加的基因型是那些缺乏或无效等位基因(在纯合或杂合状态下)编码AAT水平以下的AAT水平低于保护阈值的缺乏或无效等位基因。无效等位基因(指定为Pi Qoqo)与最严重的缺陷相关,没有产生活性AAT,或者少于正常量的血浆AAT的1%。最常见的AAT等位基因是Z变体和Pi*Zz
原文
17,影响内含子 16 中 287 个碱基对 alu 序列的插入(等位基因 I)或缺失(等位基因 D)。3 这种多态性呈现三种基因型(II、DD 和 ID),其中 I 等位基因与酶活性降低有关,D 等位基因与活性增加有关,与 HF 加剧和超重风险相关。3-5 除了影响血压外,ACE 还抑制脂肪细胞分化,限制脂肪生成和脂肪组织储存,导致异位脂质沉积,影响心脏功能并导致功能障碍。4,5-9 虽然先前的研究将 ACE 多态性与系统性动脉高血压 (SAH) 倾向联系起来,10 但关于其与 HF 关联的文献有限。本研究旨在通过探索 HF 患者多态性、心脏功能和肥胖之间的相互作用来填补这一空白,为疾病管理提供见解,了解 D 等位基因和 DD 基因型对超重倾向和心血管功能恶化的影响。本研究的目的是评估 HF 患者的肥胖、心脏功能及其与 ACE 多态性的关联。
通过 CRISPR 生成的大豆 KASI 直系同源基因和敲除等位基因观察到相似的种子组成表型
在模型植物系统中,b-酮酰基-[酰基载体蛋白]合酶 1 (KASI) 基因已被证明对蔗糖转化为油至关重要。先前的一项研究描述了与相互染色体易位相关的形态和种子组成表型,这种易位破坏了大豆中的一种 KASI 基因。这项研究的主要发现包括种子起皱表型、种子蔗糖增加、种子油减少和易位传播频率低。然而,仍不清楚这些表型中的哪一个(如果有的话)是由 KASI 基因功能丧失直接引起的,而不是染色体易位或其他相关因素。在本研究中,使用 CRISPR/Cas9 诱变来生成该基因的多个敲除等位基因,以及一个符合读框的等位基因。对这些大豆植物的形态、种子组成性状和遗传传递进行了评估。我们的结果表明,CRISPR/Cas9 突变体表现出与染色体易位突变体相同的表型,证实了观察到的表型是由基因功能丧失引起的。此外,与含有纯合敲除突变的植物相比,含有纯合框内突变的植物表现出相似的表型。这一结果表明,框内突变体中丢失的氨基酸对于基因的正常功能至关重要。为了产生新的种子组成表型,该基因的框内编辑可能需要靶向不太重要和/或进化保守的结构域。
设计未来作物:基因组学辅助育种是年龄
在过去的十年中,基因组学辅助育种(GAB)一直在利用现代基因组资源的潜力以及表征和利用等位基因变异以增强种质和品种的发展。将来维持GAB(GAB 2.0)将依靠一套新方法,这些方法快速轨道针对性地操纵等位基因变异来创造新的多样性并促进其在作物改善计划中的快速而有效的融合。基因组繁殖策略,可优化作物基因组,并积累有益的等位基因和净化有害等位基因的基因组繁殖策略对于设计未来的作物是必不可少的。在未来几十年中,GAB 2.0预计将以具有成本效益和及时的方式繁殖更多具有更高营养价值的气候智能作物品种至关重要的作用。
用于SNP检测的简单的一步PCR分析
聚合酶链反应(PCR)是检测自然变异或实验引入研究和临床环境的变化以及一种广泛使用的基因分型方法的强大工具。单核苷酸多态性(SNP)检测在PCR中具有挑战性,因为变体和野生型等位基因仅通过一种核苷酸而异。传统的检测SNP的方法,包括Sanger测序和商业套件,通常很耗时。在这里,我们描述了一种简单的引物设计策略,该策略可以通过常规的一步PCR实现特定的变体检测。该策略使用与染色体单一不匹配的引物采用基因组PCR的差异效率,该引物与包含要检测到的SNP(通常是变体等位基因)的染色体,而与两个不匹配的染色体(通常为变体等位基因)(通常是相应的替代等位基因)(通常是野生类型等位基因)。迄今为止,我们已经成功地采用了这种方法来检测20多个SNP。该方法的简单性和鲁棒性允许快速应用到遗产突变以及新发现或生成的SNP中。
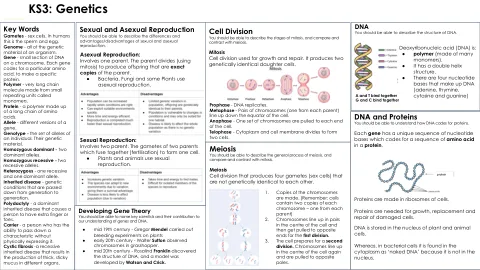
ks3:遗传学
关键词配子 - 性细胞。在人类中,这是精子和鸡蛋。基因组 - 生物体的所有遗传物质。基因 - 染色体上DNA的小部分。每个基因代码特定的氨基酸,以制成特定蛋白质。聚合物 - 由称为单体的小重复单元制成的非常长的链分子。蛋白质 - 由长氨基酸链组成的聚合物。等位基因 - 基因的不同版本。基因型 - 个体的等位基因集。他们的遗传物质。纯合占主导地位 - 两个主要等位基因。纯合隐性 - 两个隐性等位基因。杂合 - 一个隐性和一个主导等位基因。遗传性疾病 - 一代世代相传的遗传疾病。多态度 - 一种主要的遗传疾病,会导致一个人具有额外的手指或脚趾。载体 - 一个能够在不进行物理表达的情况下传递特征的人。囊性纤维化 - 一种隐性遗传性疾病,导致在不同器官中产生厚实的粘性粘液。
人类遗传学练习的其他示例
在下面的家谱中。图中还显示了 RFLP 的 DNA 带型。以1和2为标记带,用M和m表示疾病的突变和非突变等位基因,用A1和A2表示分别对应于1和2带的等位基因:a)指出是否有疾病基因和RFLP之间关联的证据b)如果有关联证据,列出所有重组受试者,并估计疾病基因和RFLP之间重组的频率c)推断第一代受试者(仅第一代)相对于疾病等位基因和RFLP的基因型; d) 解释为什么没有人只拥有最小的 DNA 片段(价值 8 分)
有害等位基因频率、遗传搭便车和连锁不平衡的变化揭示了非洲水牛在大陆范围内的高遗传负荷
高遗传负荷会对种群生存力产生负面影响,并增加对疾病和其他环境压力源的易感性。之前对南非两个非洲水牛 (Syncerus caffer) 种群进行的微卫星研究表明,由于有害等位基因的高频率出现,全基因组遗传负荷很大。本研究评估了这些等位基因在大部分水牛分布范围内的出现情况,它们对雄性身体状况和牛结核病抗性产生负面影响。利用来自 34 个地方(从南纬 25 度到北纬 5 度)1,676 头动物的现有微卫星数据(2-17 个微卫星位点),我们发现了与上述雄性特征相关的整个大陆的微卫星等位基因频率梯度。频率在从南到北的纬度范围内下降(每个位点的平均 Pearson r = -0.22)。频率变化与多位点杂合性变化相一致(调整后的 R 2 = 0.84),与东非相比,南部非洲的杂合性下降幅度高达 16%。此外,在五个连锁位点对上检测到了大陆范围的连锁不平衡 (LD),其特点是雄性有害性状相关等位基因之间存在较高的正位点间关联比例(0.66,95% CI:0.53,0.77)。我们的研究结果表明,早期观察到的性染色体减数分裂驱动系统驱动了大陆范围和基因组范围内的雄性有害等位基因选择,导致频率变化、搭便车效应导致的杂合性降低以及由于雄性有害等位基因在单倍型中同时出现而导致的广泛 LD。所涉及的选择压力必须很高,以防止等位基因频率谱系和单倍型因 LD 衰减而遭到破坏。由于大多数水牛种群是稳定的,这些结果表明,自然哺乳动物种群(取决于其遗传背景)可以承受较高的遗传负荷。
使用 CRISPR/Cas9 对亨廷顿氏病中的功能获得性突变进行等位基因特异性沉默
简介亨廷顿舞蹈症 (HD) 是由亨廷顿基因 ( HTT) 第一个外显子上的 CAG 三核苷酸重复序列扩增引起的 (1)。CAG 重复序列大于 35 会导致患者出现特征性运动症状,且发病年龄与重复序列长度呈负相关 (2)。总体而言,CAG 重复序列扩增的大小以完全显性方式解释了约 60% 的发病年龄差异 (3),而无法解释的差异与各种基因位点有关 (4, 5)。这表明,亨廷顿舞蹈症的发病率主要由 CAG 重复序列的大小决定,并受其他基因的进一步影响 (5)。尽管亨廷顿舞蹈症的病因已被人们所知 25 多年 (1),但尚未开发出有效的治疗方法,这可能是因为亨廷顿舞蹈症的潜在疾病生物学原理复杂。
等位基因特异性基因编辑方法用于恢复 RHO 相关视网膜色素变性患者的视力丧失
。CC-BY 4.0 国际许可证永久有效。它是在预印本(未经同行评审认证)下提供的,作者/资助者已授予 bioRxiv 许可,可以在该版本中显示预印本。版权持有者于 2022 年 11 月 16 日发布了此版本。;https://doi.org/10.1101/2022.11.16.516784 doi:bioRxiv 预印本