XiaoMi-AI文件搜索系统
World File Search Systemntla-5001,crispr- ...
本演示文稿包含Intellia Therapeutics,Inc。(“ Intellia”,“我们”或“我们的”)的“前瞻性陈述”,这是1995年《私人证券诉讼改革法》的含义。这些前瞻性陈述包括但不限于有关Intellia关于其信念和期望的明示或暗示陈述:向NTLA-5001提交研究性新药(“ IND”)申请或类似的临床试验申请,其第一个T细胞受体(“ TCR”)指导性细胞治疗疗法开发的第一个急诊Myeloid Leukemia(AM)(AM)的第一个指导性细胞治疗疗法(“ TCR”)的疗法(计划进步和完成临床前研究以及其他支持其他体内和体内计划的动物研究,包括其AML计划;开发模块化平台,以提高其复杂的基因组编辑功能,例如基因插入;进一步开发其专有的细胞工程过程,用于多次顺序编辑;在即将举行的科学会议上介绍其他数据,以及2020年的其他临床前数据;其CRISPR/CAS9技术的发展和扩展,以开发人类治疗产品,以及维护和扩展其相关知识产权组合的能力;能够在临床前研究中证明其平台的模块化并复制或应用结果,包括其未来的AML计划中的任何研究,包括人类临床试验;能够使用CRISPR/CAS9技术开发所有类型的其他类型的其他体内或Ex Vivo细胞疗法,尤其是针对AML中的WT1;以及有关监管申请和临床试验执行时间的时间,包括患者的剂量,有关其开发计划的剂量;以及我们产品候选人的潜在商业机会,包括价值和市场。
工程耐药的NK细胞疗法
同种异体细胞免疫疗法(将健康供体的免疫细胞注入患者中)由于其成本效益,可伸缩性和点播可用性而有可能彻底改变癌症治疗。然而,同种异体细胞的免疫原性和有限的持久性仍然是实现这些疗法持续和稳健的抗肿瘤反应的重要障碍。一种解决同种异细胞免疫原性的常见策略是HLA分子的遗传基因敲除,这是向T细胞呈现抗原的表面蛋白,这有效地消除了T细胞介导的排斥反应。然而,这些HLA分子的丢失通过缺失自然识别而被宿主自然杀手(NK)细胞触发了排斥。因此,有必要将靶向NK细胞的免疫调节策略与HLA敲除,以便充分保护同种异体细胞免受宿主免疫系统的影响。在本次研讨会中,我首先证明,敲除免疫突触中的关键粘附配体,特别是ICAM-1和CD58,广泛保护了同种异体IPSC衍生的NK细胞免受宿主NK细胞介导的抑制的抑制。然后,我将讨论如何将这种方法扩展到Adapt NK细胞平台,这是一种高度细胞毒性的,由体内扩展的原发性NK细胞平台,该平台有助于进入临床试验。在这种情况下,我通过将基于microRNA的SHRNA掺入嵌合抗原受体(CAR)质粒中,开发了一种单发方法来敲击粘附配体敲低,从而可以同时增强适应性NK细胞功能和对异常的耐药性。我将通过概述我对未来实验室的愿景来结束研讨会,我的目标是将我在NK细胞工程中的专业知识与我的生物材料背景相结合,以开发下一代NK细胞疗法,以治疗实体瘤和免疫介导的疾病。
安全驱动 CAR T 细胞走向未来的工程策略
嵌合抗原受体 (CAR) T 细胞疗法在过去十年中已被证明是癌症治疗的突破,在对抗血液系统恶性肿瘤方面取得了前所未有的成果。所有获批的 CAR T 细胞产品以及许多正在临床试验中评估的产品都是使用病毒载体生成的,以将外源遗传物质部署到 T 细胞中。病毒载体在基因传递方面具有悠久的临床历史,因此经过了反复优化以提高其效率和安全性。尽管如此,它们半随机整合到宿主基因组中的能力使它们有可能通过插入诱变和关键细胞基因失调而致癌。CAR T 细胞给药后的继发性癌症似乎是一种罕见的不良事件。然而,过去几年记录的几起案例使人们关注到这个问题,鉴于 CAR-T 细胞疗法的部署相对较晚,这个问题迄今为止可能被低估了。此外,在血液系统恶性肿瘤中获得的初步成功尚未在实体瘤中复制。现在很明显,需要进一步增强以使 CAR-T 细胞增加长期持久性,克服疲惫并应对免疫抑制肿瘤微环境。为此,各种基因组工程策略正在评估中,大多数依赖于 CRISPR/Cas9 或其他基因编辑技术。这些方法可能会在产品细胞中引入意外的、不可逆的基因组改变。在本综述的第一部分,我们将讨论用于生成 CAR T 细胞的病毒和非病毒方法,而在第二部分,我们将重点介绍基因编辑和非基因编辑 T 细胞工程,特别关注其优势、局限性和安全性。最后,我们将严格分析不同的基因部署和基因组工程组合,为生产下一代 CAR T 细胞制定具有卓越安全性的策略。
生化工程的基础
2022年秋季教练Shahana Khurshid博士编号SSE 4楼,R。'Bob'Byron Bird Wing,9-457A办公室时间TBA电子邮件shahana.khurshid@lums.edu.pk电话3739教学助理TBA课程教学方法学方法学:课程旨在亲自同步教授。课程基本学分3次讲座每周2个持续时间75分钟(T 10:00-11:15)朗诵/实验室/实验室(每周)NBR(每周)每周持续时间教程(每周)每周lec(s)每周1个持续时间的学生类别的学生类别的学生类别不开放学生类别,该课程的学生类别不开放学生类别的学生类别。化学工程在生物系统中的应用。生物系统很复杂。他们遵守化学和物理规则,并且容易受到工程分析的影响。生化工程师在生物技术,食品和制药行业的商业尺度上使用活细胞来开发新药物,半合成器官,营养食品,降解污染物等。作为一名生化工程师,您将设计和操作包含活细胞和生物分子的系统,设计和操作生物过程以生产生物分子和药物,并将生物学原理应用于活细胞的工程。本课程将为您提供生化工程学的基本知识,该知识将为追求生物技术,生物工程和制药行业的职业或研究生学习打开大门。我们还旨在涵盖细胞培养和细胞工程,包括通过经典和重组DNA技术对细胞进行遗传操纵。在本课程中不假定化学工程的初步知识,我们将以新生化学和生物学教授的概念为基础。我们将涵盖酶技术;生物反应器和微生物发酵的设计;生物产品的分离;化学和生化合成中的微生物。这些将包括热量和传质的概念,以及定量工程原理在生物过程分析中的应用,包括热力学,动力学和化学计量。课程先决条件
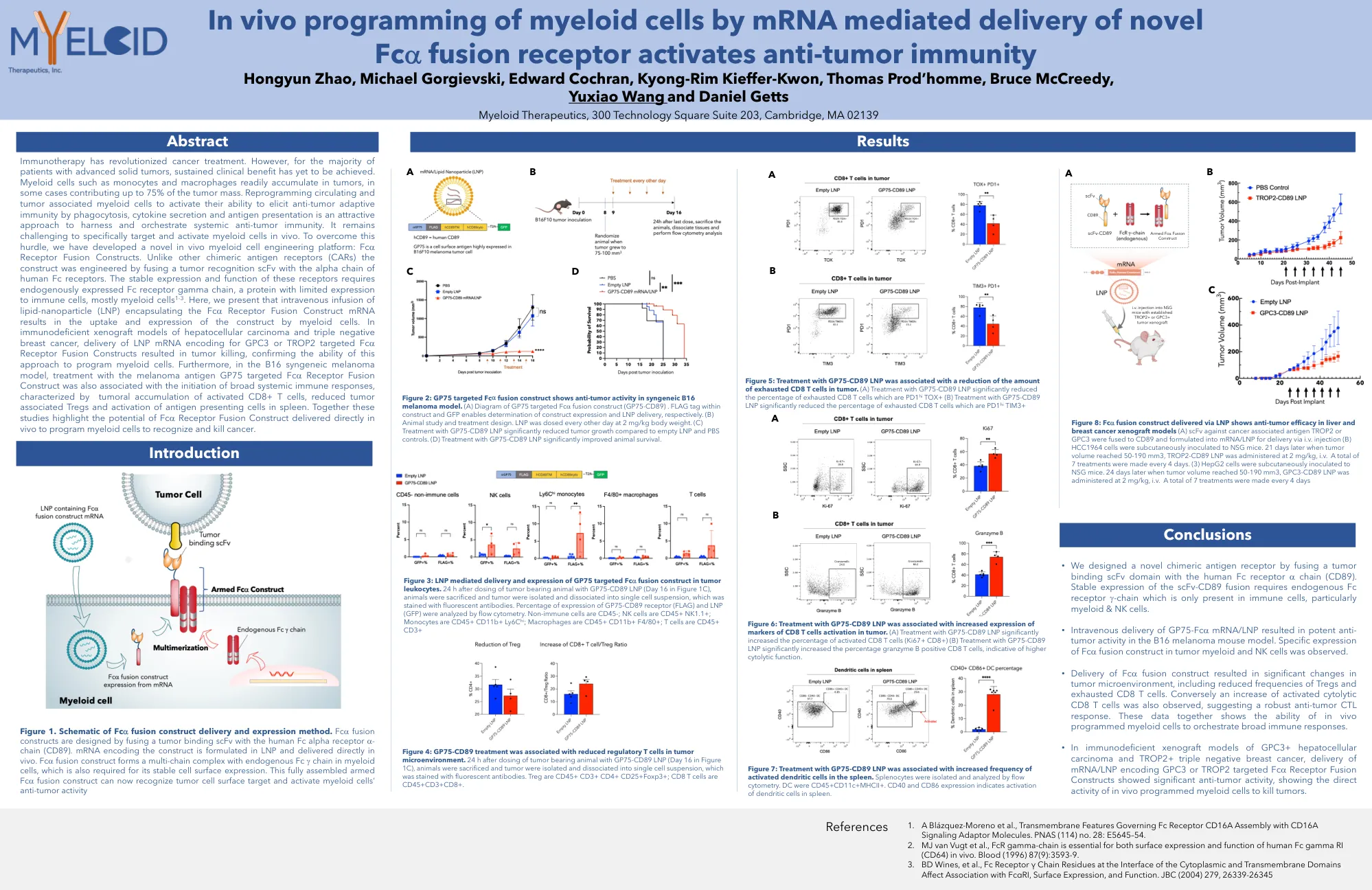
AACR2022体内递送海报
免疫疗法彻底改变了癌症治疗。但是,对于大多数晚期实体瘤患者,尚未实现持续的临床益处。髓样细胞(如单核细胞和巨噬细胞)很容易积聚在肿瘤中,在某些情况下,肿瘤质量的75%。重编程循环和肿瘤与髓样细胞相关,以激活其通过吞噬作用,细胞因子分泌和抗原表现来激活抗肿瘤适应性免疫的能力,是一种有吸引力的方法,可利用并策划系统性的抗肿瘤免疫。在体内专门靶向和激活髓样细胞仍然具有挑战性。为了克服这一障碍,我们开发了一种新型的体内髓细胞工程平台:FC A受体融合构建体。与其他嵌合抗原受体(CAR)不同,该构建体是通过将肿瘤识别SCFV与人体FC受体的α链融合而设计的。这些受体的稳定表达和功能需要内源表达的FC受体γ链,FC受体γ链是一种对免疫细胞表达有限的蛋白质,主要是髓样细胞1-3。在这里,我们介绍了包裹FC A受体融合构建体mRNA的静脉输注脂质 - 纳米颗粒(LNP)导致髓样细胞对构建体的摄取和表达。在肝细胞癌和三重阴性乳腺癌的免疫缺陷异种移植模型中,针对GPC3或trop2靶向FC的LNP mRNA的递送A受体融合构建体导致肿瘤杀死,从而确认了这种方法为骨髓细胞编程的能力。此外,在B16合成性黑色素瘤模型中,用黑色素瘤抗原GP75靶向FC A受体融合构建体的治疗也与启动广泛的全身免疫反应的启动有关,其特征在于肿瘤积累活化的CD8+ T细胞,可减少与肿瘤相关的TREG和SpleeNing spleen and spleen spleen and spleen的活化。这些研究共同强调了FC A受体融合构建体的潜力,直接在体内传递以编程髓样细胞以识别和杀死癌症。
Anna将成为部分
传记安娜·帕塞托(Anna Pasetto)是一位具有丰富的免疫学家和分子生物技术学家,在癌症研究和细胞疗法方面具有丰富的经验。出生于1982年4月13日,她目前担任多个关键学术和研究角色,包括奥斯陆大学医院ACT中心主任,奥斯陆大学副教授,以及瑞典Karolinska Institutet的研究专家。在这些角色中,Pasetto博士致力于推进免疫疗法领域,专注于治疗癌症和原发性免疫缺陷的尖端方法。Pasetto博士的学术旅程始于博洛尼亚大学,在那里她完成了学士学位和分子生物技术硕士学位。 然后她获得了博士学位。著名的Karolinska Institutet医学科学学院,2012年毕业。 在博士生研究之后,她加入了美国国家癌症研究所(NCI),在那里她担任博士后研究员,后来担任研究人员,直到2018年。。Pasetto博士的学术旅程始于博洛尼亚大学,在那里她完成了学士学位和分子生物技术硕士学位。然后她获得了博士学位。著名的Karolinska Institutet医学科学学院,2012年毕业。在博士生研究之后,她加入了美国国家癌症研究所(NCI),在那里她担任博士后研究员,后来担任研究人员,直到2018年。她在NCI的研究为我们对癌症T细胞疗法的理解做出了重大贡献。在美国任职后,帕塞托博士回到欧洲领导Karolinska Institutet的GMP之前的设施,在那里她担任董事总经理,同时还负责担任助理教授的责任。在2022年,她过渡到了目前在挪威和瑞典的职位,在那里她继续在免疫疗法和蜂窝疗法中推动创新。Pasetto博士也对教学和指导充满热情。她曾在Karolinska Institutet和巴西的GonçaloMoniz研究所在免疫学上讲授免疫学,并与下一代科学家分享了她的专业知识。在奥斯陆大学,她是创新学校中的导师,在那里她指导学生开发新颖的生物医学解决方案。博士学位主管Pasetto博士的学生负责监督高级免疫学技术的几项研究项目,包括基于CRISPR的疗法和T细胞工程。她的工作是将基础科学转化为临床应用的最前沿,目的是为患者开发更有效的疗法。
基因设计的巨噬细胞持续存在于实体瘤中,并局部提供治疗蛋白以激活免疫反应
背景我们设计了未分离的外周血单核细胞(PBMC),以充当抗原呈递细胞(APC),产生有效的CD8+ T细胞反应。我们研究了基于PBMC的癌症与靶向白细胞介素2变体(IL2V)的综合疗效;抗细胞死亡蛋白1(MUPD1-IL2V)和抗纤维细胞激活蛋白(MUFAP-IL2V)。方法,我们使用微流体细胞工程系统(CellSqueeze®)生成了基于PBMC的癌症疫苗,该系统促进了直接的胞质抗原递送,并在PBMC中启用细胞子组以充当APC。所使用的免疫细胞因子包含与抗体相关的基质或免疫细胞(分别为AFAP和APD-1)拟合抗体的IL2V,并具有修饰的FCR结合。与野生型IL-2相比,IL2V部分仅消除了与IL-2RA(CD25)的结合,仅导致IL-2RGB结合,从而完全维持对NK和CD8+ T细胞的活性,同时避免TREG活性和CD25介导的毒性。Results In the murine TC-1 HPV tumor model, SQZ-PBMC- based vaccines show efficacy as monotherapy (1e6 cells admin- istered iv on day 14 post-tumor implant), while SQZ combi- nation therapy with targeted immunocytokines, muPD1-IL2v and muFAP-IL2v (2 mg/kg or 1 mg/kg, respectively, adminis-在第21、28和35天的肿瘤植入物中进行了IV,这显着延迟了肿瘤的生长,并改善了鼠TC-1 HPV肿瘤模型的生存率。在一项机械研究中,SQZ-PBMC与MUPD1-IL2V结合使用,导致肿瘤内抗原特异性CD8+ T细胞的扩张增加组合治疗组的中位生存期在肿瘤后第84天保持不确定,而单一治疗治疗组的中位生存时间分别计算出MUFAP-IL2V,MUPD1-IL2V和SQZ单一疗法组的中位生存时间为36.5、42和70天。初始肿瘤清除率后,无肿瘤的小鼠(SQZ单一疗法的2/12只动物;用MUFAP-IL2V进行SQZ的8/12只动物;与MUFAP-IL2V的动物; 11/11动物,用于使用MUPD1-IL2V的SQZ进行SQZ,第84天都重新挑选了第84天,并至少在肿瘤后至少恢复了7周后,并在静止后响应了7周,建议静止后的静力,建议静止量。
乳腺癌的PET/CT成像进展
1个细胞工程中心,纽约纽约,纽约,纽约10065,美国; ddejong990@gmail.com 2哥伦比亚大学欧文医学中心放射科,美国纽约,纽约10032; ed2202@cumc.columbia.edu(e.d.); ld2752@cumc.columbia.edu(L.D.); hym2103@cumc.columbia.edu(H.M.); abs9064@nyp.org(a.s.); braumuller.b@northeastern.edu(B.B.); cprender@student.nymc.edu(c.p.); col9043@nyp.org(c.l.); tir7004@nyp.org(T.R.); ms5680@cumc.columbia.edu(m.m.s.)3 Refer Exion Medical,Inc.,Hayward,CA 94545,美国; kfeghali@reflefecom.com 4核医学和内分泌肿瘤学系,法国圣库洛德92210研究所; romaindavid.seban@curie.fr 5肿瘤学转化成像实验室,巴黎科学及LETTRES(PSL)研究大学,研究所,Curie Institut Curie,91401 ORSAY,法国6号放射学系,纪念Sloerial Sloerial Sloan Kettering Kettering Castering Cancer Center,纽约,纽约,10065,美国,美国; dasj@mskcc.org(J.P.D. ); yehr@mskcc.org(R.Y。) 7 Novant Health,Novant Health,Medical Park Road,Mooresville,NC 28117,Novant Health的血液和肿瘤学系; adeng87@gmail.com 8核医学系中心,埃格·纳马奎(EugèneMarquis) a.girard@rennes.unicancer.fr *通信:kmc2113@cumc.columbia.edu;电话。 : +1-908-672-61603 Refer Exion Medical,Inc.,Hayward,CA 94545,美国; kfeghali@reflefecom.com 4核医学和内分泌肿瘤学系,法国圣库洛德92210研究所; romaindavid.seban@curie.fr 5肿瘤学转化成像实验室,巴黎科学及LETTRES(PSL)研究大学,研究所,Curie Institut Curie,91401 ORSAY,法国6号放射学系,纪念Sloerial Sloerial Sloan Kettering Kettering Castering Cancer Center,纽约,纽约,10065,美国,美国; dasj@mskcc.org(J.P.D.); yehr@mskcc.org(R.Y。)7 Novant Health,Novant Health,Medical Park Road,Mooresville,NC 28117,Novant Health的血液和肿瘤学系; adeng87@gmail.com 8核医学系中心,埃格·纳马奎(EugèneMarquis) a.girard@rennes.unicancer.fr *通信:kmc2113@cumc.columbia.edu;电话。 : +1-908-672-61607 Novant Health,Novant Health,Medical Park Road,Mooresville,NC 28117,Novant Health的血液和肿瘤学系; adeng87@gmail.com 8核医学系中心,埃格·纳马奎(EugèneMarquis) a.girard@rennes.unicancer.fr *通信:kmc2113@cumc.columbia.edu;电话。: +1-908-672-6160
HLA-A/B/C敲除电穿孔套件
说明HLA-A/B/C敲除电穿孔套件适用于通过电穿孔的细胞系和原代T细胞工程。该套件既包含Cas9酶(链球菌)和靶向HLA-A/B/C(人白细胞抗原)的GRNA。该套件足以设计高达500万个原代T细胞。背景HLA(人白细胞抗原)-a,b和c是MHC的三种主要类型(主要的组织相容性复合物)1类跨膜蛋白。它们与β2微球蛋白蛋白(由B2M基因编码)形成异二聚体。MHC 1类分子表现出短多肽,通常在长7-11个氨基酸之间,以识别为“自我”或“非自身”的免疫系统。HLA-C存在于所有细胞中,并且由于HLA-C基因的多样性而作为几种单倍型存在。c*08:02代表一种这样的单倍型。HLA I类将新抗原衍生的肽呈现到细胞表面,从而通过TCR(T细胞受体)识别出T细胞的识别。 癌症免疫疗法一直在使用该机制,方法是表达能够识别特定癌症免疫原子的TCR。 在2016年,HLA-C*08:02限制性TIL(肿瘤浸润淋巴细胞)在肺癌中靶向KRAS(Kirsten大鼠肉瘤病毒)G12D突变,导致阳性结果。 在转移性胰腺癌患者中采用了类似的方法,并导致该疾病的消退。 HLA-C*08:02限制性TIL对其他新抗原的TCR的研究可能对癌症治疗有益。 应用程序HLA I类将新抗原衍生的肽呈现到细胞表面,从而通过TCR(T细胞受体)识别出T细胞的识别。癌症免疫疗法一直在使用该机制,方法是表达能够识别特定癌症免疫原子的TCR。在2016年,HLA-C*08:02限制性TIL(肿瘤浸润淋巴细胞)在肺癌中靶向KRAS(Kirsten大鼠肉瘤病毒)G12D突变,导致阳性结果。在转移性胰腺癌患者中采用了类似的方法,并导致该疾病的消退。HLA-C*08:02限制性TIL对其他新抗原的TCR的研究可能对癌症治疗有益。应用程序K562细胞是HLA I和II类负的,使其成为引入和研究特定单倍型响应的理想细胞模型。hla在供体细胞和个体之间的不匹配可以导致免疫排斥反应,一种选择是敲除内源性HLA,从而使细胞被更广泛地普遍使用。
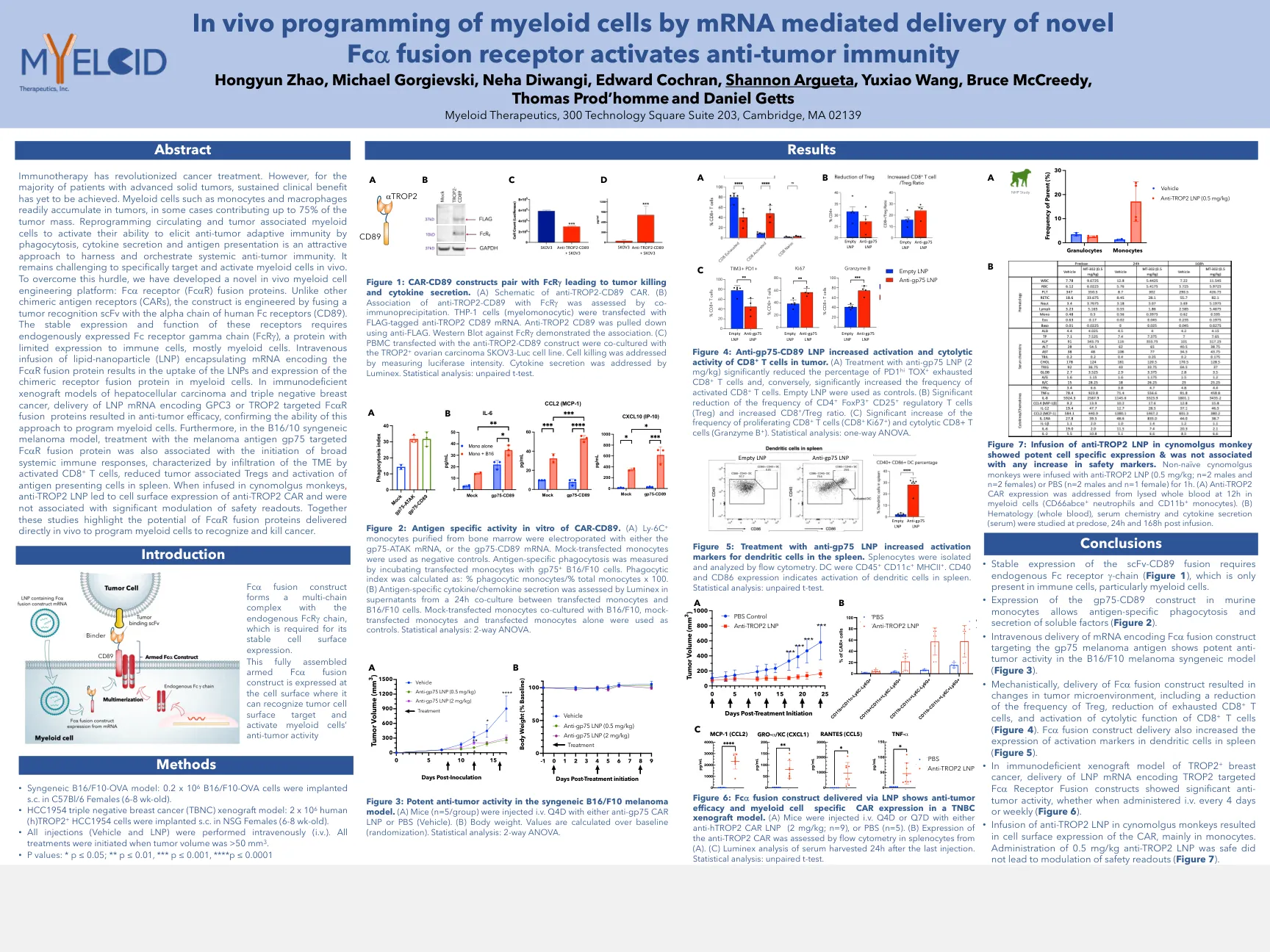
SITC-2022-IN-VIVO-DELIVERY-POSTER.pdf
免疫疗法彻底改变了癌症治疗。但是,对于大多数晚期实体瘤患者,尚未实现持续的临床益处。髓样细胞(如单核细胞和巨噬细胞)很容易积聚在肿瘤中,在某些情况下,肿瘤质量的75%。重编程循环和肿瘤与髓样细胞相关,以激活其通过吞噬作用,细胞因子分泌和抗原表现来激活抗肿瘤适应性免疫的能力,是一种有吸引力的方法,可利用并策划系统性的抗肿瘤免疫。在体内专门靶向和激活髓样细胞仍然具有挑战性。为了克服这一障碍,我们开发了一种新型的体内髓样细胞工程平台:FC A受体(FC A R)融合蛋白。与其他嵌合抗原受体(CAR)不同,该构建体是通过将肿瘤识别SCFV与人体FC受体的α链融合而设计的(CD89)。这些受体的稳定表达和功能需要内源表达的FC受体伽马链(FCR G),这是一种对免疫细胞(主要是髓样细胞)表达有限的蛋白质。术中包裹着编码FC A R融合蛋白的mRNA的脂质纳米颗粒(LNP)导致LNP的摄取并在髓样细胞中摄取嵌合受体融合蛋白的表达。在肝细胞癌的免疫缺陷异种移植模型和三重阴性乳腺癌中,编码GPC3或Trop2靶向FC A R融合蛋白的LNP mRNA的递送导致抗肿瘤疗效,从而确保了这种方法来编程髓样细胞的能力。此外,在B16/10合成性黑色素瘤模型中,用黑色素瘤抗原GP75靶向FC A R融合蛋白的治疗与启动广泛的全身免疫反应的启动,其特征在于激活的CD8 + T细胞通过激活的CD8 + T细胞浸润TME,与肿瘤相关的tregs和Antigen comcipination in Antigen of Antigen of Antigen of Antigen of Antigen of Antigen of Antigen of Antigen of Antigen of Antigen of Antigen of Antigen。当在cynomolgus猴子中注入时,抗Trop2 LNP导致了抗Trop2 Car的细胞表面表达,并且与安全读数的显着调节无关。这些研究共同强调了FC A R融合蛋白直接在体内传递以编程髓样细胞以识别和杀死癌症的潜力。