XiaoMi-AI文件搜索系统
World File Search SystemSATB2神经rest类中充质程序的诱导驱动黑色素瘤侵袭和耐药性
黑色素瘤的最新基因组和SCRNA-SEQ分析表明,缺乏转移的复发遗传驱动因素,同时鉴定出与侵袭或耐药性相关的常见转录状态。为了测试转录适应是否可以推动黑色素瘤进展,我们使用了斑马鱼MITFA:BRAFV600E; TP53 - / - 模型,其中恶性进展的特征在于最小的遗传进化。我们进行了80个表观遗传/转录调节剂的过表达屏幕,并发现神经Crest - 间质发育调节剂SATB2以加速攻击性黑素瘤发育。其过表达诱导斑马鱼肿瘤和人黑色素瘤细胞系中的侵袭性形成和侵袭。SATB2结合并激活包括PDGFAB和SNAI2在内的神经rest调节剂。由SATB2引起的转录程序与已知的MITF低AXL高和AQP1 + NGFR1高药物抗性状态重叠,并在功能上驱动肿瘤的传播增强和对Vemurafenib在Vivo中的耐药性。总而言之,我们表明,SATB2向神经rest类中充质的程序转录的黑色素瘤转录可以促进自围候肿瘤的侵袭和耐药性。
DNA目标关联中金黄色葡萄球菌Cas9的动力学 均质抗体 - 药物结合物:通过在隔离轻链上获得的偶联而获得的DAR 2抗HER2,然后是mAb组装 介孔锆 - 渗透性多功能平台 通过使用合成小分子来区分癌症干细胞:针对治疗耐药性的新治疗策略 新加坡的新经济地理 欧洲对非侵入性大脑刺激的重新分类为III类医疗设备:行动呼吁 编队的现实路线图,飞行空间干涉法 LEO卫星成像,具有自适应光学和边缘化的盲卷积 澳大利亚经济不确定性冲击的工业影响 透明加热器:评论 使用大规模扩展Granger因果关系从功能性MRI分类 数字足迹的关键方法研究城市旅游区的空间实践:Biarritz(法国)Instagram数据的案例研究
金黄色葡萄球菌CAS 9(SACAS 9)是RNA引导的内核ASE,其靶向与原始探针相邻的互补DNA相邻的邻接基序(PAM)进行裂解。其小尺寸促进了体内递送的各种生物体基因组编辑。在此,使用单分子和集合方法,我们系统地研究了SACAS 9与DNA相互作用的基础机理。我们发现SACAS 9的DNA结合和裂解需要分别与指导RNA的PAM -Proximal DNA的6-和18 -bp。这些活性是由三元复合物之间的两个稳定的相互作用介导的,其中一种稳定的相互作用位于PAM的大约6 bp,而不是DNA上Sacas 9的明显足迹。值得注意的是,原始间隔物内部的另一个相互作用显着强,因此构成了DNA结合的SACAS 9持续块对DNA跟踪电动机。有趣的是,在裂解后,萨卡斯9自主释放了pAM-DESTAL DNA,同时保持与PAM的结合。这种部分DNA释放立即废除了其与原始探针DNA的强烈相互作用,因此促进了其随后与PAM的解离。总体而言,这些数据提供了对SACAS 9的动态理解,并指导其有效的应用。
调节不可成药靶点以克服癌症治疗耐药性
* 通讯作者电子邮箱:walink@iib.uam.es (WL);romano.silvestri@uniroma1.it (RS)。本文发表于《药物耐药性更新》(Elsevier,2021 年),第 100788 页。DOI:10.1016/j.drup.2021.100788 此版本为作者版本。摘要许多癌症患者经常对抗癌治疗没有反应,因为治疗耐药性是治愈癌症治疗的主要障碍。因此,确定耐药性的分子机制具有至关重要的临床和经济意义。基于对癌症的分子理解的靶向疗法的出现可以作为克服耐药性策略的模型。因此,鉴定和验证与耐药机制密切相关的蛋白质代表了一条通往创新治疗策略的道路,以改善癌症患者的临床结果。在这篇综述中,我们讨论了新兴靶点、小分子疗法和药物输送策略,以克服治疗耐药性。我们专注于基于转录因子、假激酶、核输出受体和免疫原性细胞死亡策略的合理治疗策略。从历史上看,未配体的转录因子和假激酶被认为是不可药用的,而通过抑制核输出受体 CRM1 来阻断核输出则被认为具有高度毒性。最近成功抑制 Gli HIF-1α、HIF-2α 并重新激活肿瘤抑制转录因子 p53 和 FOXO 说明了这种靶向方法的可行性和强大性。同样,在调节与治疗耐药性有关的假激酶蛋白(包括 Tribbles 蛋白家族成员)的活性方面也取得了进展。另一方面,Selinexor 是一种 CRM-1 的特异性抑制剂,CRM-1 是一种介导富含亮氨酸的核输出信号货物运输的蛋白质,已知是药物耐药性的驱动因素,它代表了抑制核输出作为克服治疗耐药性的可行策略的概念验证。
组合的统计生物物理建模将离子通道基因与皮质神经元类型的生理学联系英国兽医中心的一种抗菌耐药性健康监测的宏基因组方法
。cc-by-nd 4.0国际许可证。是在预印本下提供的(未经同行评审的认证)是作者/资助者,他已授予Biorxiv的许可证,以在2025年2月14日发布的此版本中显示在版权所有的此版本中。 https://doi.org/10.1101/2025.02.12.12.636430 doi:Biorxiv Preprint
靶向线粒体复合物 I 可克服高 OXPHOS 胰腺癌的化学耐药性
Rawand Masoud, 1,3,* Gabriela Reyes-Castellanos, 1,3 Sophie Lac, 1,4 Julie Garcia, 1 Samir Dou, 1 Laetitia Shintu, 2 Nadine Abdel Hadi, 1 Tristan Gicquel, 1 Abdessamad El Kaoutari, 1 Binta Die´ me´, 2,5 Fabrice Tranchida, 2 Laurie Cormareche, 1 Laurence Borge, 1 Odile Gayet, 1 Eddy Pasquier, 1 Nelson Dusetti, 1 Juan Iovanna, 1 和 Alice Carrier 1,6,* 1 艾克斯马赛大学、CNRS、INSERM、Paoli-Calmettes 研究所、马赛癌症研究中心 (CRCM)、F-13009 马赛,法国 2 艾克斯马赛大学、CNRS、马赛中央理工学院、ISM2、F-13013法国马赛 3 这些作者贡献相同 4 现地址:Innate Pharma,F-13009 马赛,法国 5 现地址:克莱蒙费朗化学研究所,PlateForme d’Exploration du Metabolisme (PFEM),克莱蒙奥弗涅大学,F-63000 克莱蒙费朗,法国 6 主要联系人 *通信地址:masoud.rawand@gmail.com (RM)、alice.carrier@inserm.fr (AC)
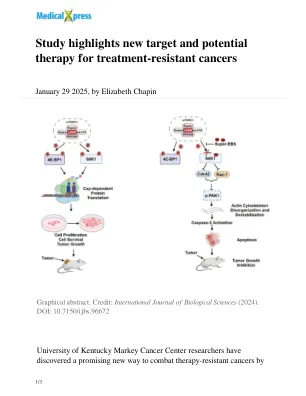
研究强调了治疗耐药性癌症的新靶点和潜在疗法
癌细胞通常会通过改变其特性(一种称为细胞可塑性的过程)来对治疗产生耐药性。研究发现,随着癌症产生这种耐药性,它们会变得更加依赖磷酸化的 S6K1,从而使它们更容易受到新治疗方法的攻击。这项研究为未来研究 Super-EBS 和相关化合物以开发针对治疗耐药性癌症的靶向疗法打开了大门。
单细胞 DNA 测序描绘了奥希替尼耐药患者中多个驱动变异的克隆进化
1 巴黎萨克雷大学,古斯塔夫鲁西,INSERM U981,维尔瑞夫; 2 药物开发部(DITEP),Gustave Roussy,维尔瑞夫; 3 维尔瑞夫古斯塔夫鲁西肿瘤医学系; 4 PRISM 研究所,Gustave Roussy,维尔瑞夫; 5 巴黎萨克雷大学 INSERM 生物统计学和流行病学办公室,Gustave Roussy,Oncostat U1018,标记为 Ligue Contre le Cancer,Villejuif; 6 实验和转化病理学平台(PETRA)、基因组平台 - 分子生物病理学单位(BMO)和生物资源中心、AMMICA、INSERM US23/CNRS UMS3655、Gustave Roussy、巴黎萨克雷大学、维尔瑞夫; 7 维尔瑞夫古斯塔夫鲁西医学生物学和病理学系; 8 介入放射学系,Gustave Roussy,维尔瑞夫; 9 法国马赛艾克斯马赛大学、法国国立科学研究院、法国国家健康与医学研究院、法国马赛临床医学研究中心
GluK2 是耐药性颞叶癫痫基因治疗的靶点
目的:颞叶癫痫 (TLE) 的特征是边缘系统(尤其是海马)中反复发作癫痫。在 TLE 中,从齿状回颗粒细胞 (DGC) 中反复出现的苔藓纤维在 DGC 之间形成异常的致癫痫网络,该网络通过异位表达的含 GluK2/GluK5 的海人酸受体 (KAR) 起作用。TLE 患者通常对抗癫痫药物有抵抗力,并患有严重的合并症;因此,迫切需要新的治疗方法。之前,我们已经证明 GluK2 基因敲除小鼠可以免受癫痫发作的影响。本研究旨在提供证据,证明使用基因疗法下调海马中的 KAR 可以减少 TLE 中的慢性癫痫放电。方法:我们将分子生物学和电生理学结合到啮齿类 TLE 模型和从耐药性 TLE 患者手术切除的海马切片中。结果:在这里,我们确认了使用非选择性 KAR 拮抗剂抑制 KAR 的转化潜力,该拮抗剂显着减弱了 TLE 患者来源的海马切片中的发作间期样癫痫样放电 (IED)。表达抗 grik2 miRNA 的腺相关病毒 (AAV) 血清型 9 载体被设计为特异性下调 GluK2 表达。将 AAV9-抗 grik2 miRNA 直接递送到 TLE 小鼠的海马中可显着减少癫痫发作活动。TLE 患者海马切片的转导降低了 GluK2 蛋白的水平,最重要的是,显着减少了 IED。解释:我们抑制异常 GluK2 表达的基因沉默策略可抑制小鼠 TLE 模型中的慢性癫痫发作以及来自 TLE 患者的培养切片中的 IED。这些结果为针对耐药性 TLE 患者的 GluK2 KAR 基因治疗方法提供了概念验证。ANN NEUROL 2023;00:1 – 17
胰腺腺癌的代谢组学分析揭示了驱动临床结果和耐药性的关键特征
背景:尽管最近在胰腺导管腺癌 (PDAC) 生物学特征描述方面取得了重大进展,但仍需付出更多努力来提高我们的认识,并应对与该疾病的侵袭性、高死亡率和化疗耐药性相关的挑战。方法:在本研究中,我们对 77 例 PDAC 患者来源的肿瘤异种移植 (PDTX) 进行了代谢组学分析,以研究代谢谱与 PDAC 患者的总生存期 (OS)、肿瘤表型和对五种抗癌药物 (吉西他滨、奥沙利铂、多西他赛、SN-38 和 5-氟尿嘧啶) 的耐药性之间的关系。结果:我们确定了一种能够预测 PDAC 患者临床结果的代谢特征 (p < 0.001,HR=2.68 [95% CI:1.5 4.9])。相关性分析表明,该代谢组学特征与 PDAC 分子梯度 (PAMG) 显著相关 (R = 0.44 和 p < 0.001),表明与肿瘤的转录组表型显著相关。使用 35 个 PDTX 衍生的原代细胞根据生长率抑制指标建立的耐药性评分可以识别出几种与耐药性相关的代谢物,耐药性同时伴随着几种二酰基磷脂的全球积累和溶血磷脂的减少。有趣的是,针对甘油磷脂合成提高了对三种测试的细胞毒药物的敏感性,这表明干扰代谢可能是克服 PDAC 挑战性耐药性的一种有前途的治疗策略。解读:总之,这项研究表明胰腺 PDTX 模型的代谢组学谱与临床结果、转录组表型和耐药性密切相关。我们还表明,针对脂质组学谱可用于治疗 PDAC 化疗耐药的联合疗法。© 2021 作者。由 Elsevier BV 出版 这是一篇根据 CC BY 许可开放获取的文章(http://creativecommons.org/licenses/by/4.0/)
o r i g i n a l r e s a r c h抗菌耐药性监测皮肤和软组织感染:医院范围内的细菌种类和抗体
目的:尽管皮肤和软组织感染(SSTIS)是常见的,但坦桑尼亚的抗菌耐药性(NAP-AMR)的国家作用计划集中于血流感染和尿路感染。这项研究评估了实验室确认的SSTI的比例,鉴定了所涉及的细菌物种,分析AMR表型,并研究了与多药耐药(MDR)SSTI相关的危险因素。患者和方法:分析横断面研究是在2023年1月至6月之间进行的,涉及614例SSTIS患者。患者的信息,并使用标准微生物程序,WHONET和Stata软件程序收集并分析了PUS拭子或脓液或坏死组织。结果:患者的中位年龄(四分位间范围)为34(14-54)年,男性占54.4%。实验室确认的SSTI为72.5%(445/614),得出586个细菌分离株。最常见的SSTIS类型是手术部位感染(30.0%),慢性伤口(27.9%)和创伤性伤口(19.7%)。最常见的病原体是金黄色葡萄球菌(17.1%),大肠杆菌(17.1%)和K.肺炎(16.0%)。鉴定出的AMR表型是金黄色葡萄球菌抗甲氧西林的29.0%;延长的谱β乳糖酶产生革兰氏阴性细菌,47.3%;和碳苯甲基阴性细菌,12.9%。与门诊患者相比,住院患者的总体SSTIS为40.9%(251/614),在住院患者中显着高于[或(95%CI); p值:1.86(1.33–2.59); p值<0.001]。结论:大约四分之三的患者已实验室确认的SSTI主要由MDR病原体引起。建议对BMC的SSTIS治疗指南进行重新访问,并建议在坦桑尼亚正在进行的AMR监视中纳入SSTIS。