XiaoMi-AI文件搜索系统
World File Search System冠状动脉微血管功能障碍和心血管疾病中的内皮自噬
摘要:冠状动脉微血管功能障碍 (CMD) 是指冠状动脉微循环的一组结构性和/或功能性障碍,可导致冠状动脉血流受损并最终导致心肌缺血。随着对病理生理机制的认识不断加深和评估工具的先进发展,CMD 已成为多种心血管疾病 (CVD) 的主要病因,包括阻塞性和非阻塞性冠状动脉疾病、糖尿病性心肌病和射血分数保留的心力衰竭。值得注意的是,内皮在调节冠状动脉微血管和心脏功能方面发挥着重要作用。重要的是,内皮自噬激活不足或不受控制会促进各种 CVD 中 CMD 的发病机制。本文,我们回顾了对冠状动脉内皮细胞自噬病理生理机制的理解进展,并讨论了它们在 CMD 和 CVD 中的潜在作用。
o r i g i g i n a l r e s a r c h关联 o r i g i n a l r e s a r c h卫生技术评估:对偏头痛治疗的8种CGRP靶向治疗药物的评估 o r i g i n a l r e s a r c h不一致的定量和视觉CT评估在诊断肺气肿 r e v i e w自噬,凋亡和铁凋亡是糖尿病性肾病发病机理的升天恒星
目的:肝脂肪变性指数(HSI)是非酒精性脂肪肝病(NAFLD)的可靠预测指标,可以增加2型糖尿病的风险(T2DM)。然而,有限的研究直接预测了HSI与正常血糖水平下T2DM的关联。因此,这项研究旨在评估在葡萄糖条件下基线HSI与T2DM发育之间的联系,同时还探索潜在的性别差异。方法:使用Nagala队列研究的数据,Cox回归模型分析了HSI与T2DM风险之间的关系,计算危害比(HR)和95%置信区间(CI)。亚组分析,以研究影响HSI预测T2DM的因素。结果:在平均6。1年的随访期间,238个人(参与者的1.65%)发展为T2DM。在调整年龄,乙醇消耗,吸烟状态,SBP,DBP,TG和TC之后,HSI与正常葡萄糖水平的个体中的入射T2DM显着相关,在各个男女之间保持一致。与最低的四分位数组(Q1)相比,Q2,Q3和Q4的HR和95%CI分别为1.09(0.61、1.93),1.16(0.68、1.98)和3.30(2.04、5.33)(趋势<0.001)。亚组分析表明,升高的HSI显着增加了TG水平正常的个体入射T2DM的风险(相互作用的P = 0.0170)。结论:这项研究强调了升高的HSI水平与患有正常葡萄糖水平的个体中入射T2DM的可能性之间的显着关联。此外,它提供了一种简单而有价值的筛选工具,可预测T2DM。关键字:2型糖尿病,肝脂肪变性指数,非酒精性脂肪肝病,风险预测,纵向研究
通过中IIR量子级联激光的ISB过渡的低强度饱和 引用:Rodani T.,Osmenaj E.,Cazzaniga A.,Panighel M.,Africh C.&Cozzini S.朝扫描隧道显微镜图像的公开化。 高... 中用于准阶段匹配的微流体设备 微生物组对主机社区动态的影响 β-氯环己烷触发神经炎症活性,表观遗传组蛋白翻译后修饰和认知功能障碍 STAT3抑制作用通过恢复肌肉干细胞中的自噬来恢复老化肌肉的再生 在... 之后,富含二氨基蛋白的意大利面的潜在益生元作用 肠道轴调节能量的新机制 电解质门控石墨烯Terahertz振幅调节器 基于空腔的纠缠光子的来源 - 纳米光子晶体D形纤维设备,用于标签... Terahertz光电检测中可伸缩的单层... 2D金属和有机框架中的带结构工程 纳米颗粒的仿生合成 开发基于约瑟夫森连接的单光子微波检测器,用于轴突检测实验 纳米... 的硅设计,建筑物和气体吸附 材料加速平台(地图):加速材料研发以应对紧急社会挑战 在软X射线照射下Fapbbr3钙钛矿的降解和自我处理
我们证明,可以设计中红外跨带过渡的吸收饱和,以10-20 kW cm 2的中等光强度和室温下。该结构由一系列具有明智设计的253 nm厚的GAAS/ALGAAS半导体异质结构的金属 - 气管导体 - 金属金属斑块组成。在低入射强度下,结构在强光 - 耦合方面起作用,并在接近8.9 L m的波长下表现出两个吸收峰。饱和作为向弱耦合方案的过渡,因此,在增加入射强度时向单峰吸收。与耦合模式理论模型进行比较解释了数据,并允许推断相关的系统参数。当泵激光器在空腔频率上调谐时,随着入射强度的增加,反射率会降低。相反,当激光器以极化频率调谐时,反射性非线性会随着入射强度的增加而增加。在这些波长下,系统模仿了MID-IR范围内可饱和吸收镜的行为,这是当前缺失的技术。
FGFR2触发的自噬和NRF-2的激活减少了乳腺癌细胞对抗ER药物的反应
©作者2024。Open Access本文是根据Creative Commons Attribution 4.0 International许可获得许可的,该许可允许以任何媒介或格式使用,共享,适应,分发和复制,只要您对原始作者和来源提供适当的信誉,请提供与创意共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的创意共享许可中,除非在伴侣的信用额度中另有说明。如果本文的创意共享许可中未包含材料,并且您的预期用途不受法定法规的允许或超过允许的用途,则您需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问http:// creativecommons.org/licenses/4.0/。
FGFR2触发的自噬和NRF-2的激活减少了乳腺癌细胞对抗ER药物的反应
©作者2024。Open Access本文是根据Creative Commons Attribution 4.0 International许可获得许可的,该许可允许以任何媒介或格式使用,共享,适应,分发和复制,只要您对原始作者和来源提供适当的信誉,请提供与创意共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的创意共享许可中,除非在伴侣的信用额度中另有说明。如果本文的创意共享许可中未包含材料,并且您的预期用途不受法定法规的允许或超过允许的用途,则您需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问http:// creativecommons.org/licenses/4.0/。
图S1。 GADD45β和... 的mRNA表达水平 osimertinib诱导的红细胞毛:病例报告 用BNT162B2 ... 对IB3-1细胞的数据S1处理 用软通道微创的激光定位... 表Si。逆转录中使用的底漆序列 - 表Si.定量RT-PCR的序列序列。 自噬/脂肪在响应中的作用... 表Si。研究中使用的siRNA和定量PCR引物序列的列表。 上调和抑制... 的核易位 由于... ,子宫后部区域的脓肿 表Si。逆转录的底漆序列 - 逆转癌症中的DNA高甲基化(综述) 表Si。乳腺癌免疫疗法及其结果的完整临床研究清单。 1个表Si。逆转录中使用的引物 - 3')鼠标-GAPDH f
摘要。本研究报告了osimertinib诱导的转移性肺腺癌Noma患者的红细胞毛的病例。osimertinib是一种通过与细胞内受体酪氨酸激酶位点结合而不可逆地抑制表皮生长因子受体(EGFR)途径的抗肿瘤药物,从而防止EGFR信号转导。伴有肺腺癌复发的77岁女性,并开了次生转移的情况下。患者在两只手的所有手指的远端面积上都表现出痛苦的红斑和温暖,这两只手的远处是热量变质并因冷而缓解。基于临床数据,红细胞毛的肌肌张力。考虑到发病的年龄,排除了原发性红细胞。进一步的研究排除了红细胞毛的其他次要原因,因此怀疑奥西司他尼是原因。尽管尚未报告EGFR抑制剂诱导的红细胞毛的病例,但已记录了EGFR抑制剂引起的皮肤不良事件。目前的情况可能是osimertinib诱导的红血病的第一个证据,可以帮助临床医生正确地支持发展此EGFR抑制剂不良事件的患者。
PI3K/AKT 信号通路介导口腔癌的自噬——综合综述
1. 沙特阿拉伯费萨尔国王大学理学院生物科学系,Al-Ahsa,31982。2. 印度泰米尔纳德邦钦奈,萨维塔大学萨维塔医学与技术科学研究所,萨维塔牙科学院与医院,分子医学与诊断学中心 (COMManD),生物化学系。3. 印度钦奈,Maduravoyal,Alapakkam Main Road,MAHER,Meenakshi Ammal 牙科学院与医院,口腔病理学与口腔微生物学系。4. 印度钦奈,Maduravoyal,Alapakkam Main Road,MAHER,Meenakshi Ammal 牙科学院与医院,口腔颌面外科系。5. 埃及开罗大学理学院植物学与微生物学系,开罗,12613。 6. 埃及艾斯乌特大学理学院动物学系,艾斯乌特 71515。7. 埃及艾斯乌特大学理学院植物学与微生物学系,艾斯乌特 71516。
PRRSV通过双自噬受体P62和CCT2降低MDA5,以逃避抗病毒先天免疫
猪繁殖和呼吸综合征病毒(PRRSV)是一种主要的经济性病原体,已经发展了各种逃避先天免疫力的策略。抗病毒干扰素的下调在很大程度上通过利用细胞质黑色素瘤分化相关基因5(MDA5)来促进PRRSV免疫抗性,这是一种感受病毒RNA的受体。在这项研究中,观察到PRRSV感染中猪MDA5的下调转录和表达水平,并探索了详细的机制。我们发现,由于两个因素,p62和MDA5之间的相互作用得到了增强:上调的激酶CK2α和K63泛素化磷酸化受体p62的磷酸化修饰和由e3 Ubiquitinase Trim21催化的猪MDA5催化的猪MDA5的K63泛素化。由于这些修改,触发了经典的p62介导的自噬。此外,猪MDA5与含有TCP1亚基2(CCT2)的伴侣蛋白相互作用,该伴侣通过PRRSV NSP3增强。这种相互作用促进了独立于泛素化的MDA5-CCT2-NSP3的骨料形成和自噬清除率。总而言之,通过两种自噬途径在PRRSV感染中发生了增强的MDA5降解:MDA5与自噬受体p62和凝集受体CCT2的结合,导致强烈的先天免疫抑制。这项研究揭示了PRRSV感染中免疫逃避的一种新型机制,并为开发新疫苗或治疗策略提供了基本见解。
2024; 20(7): 2532-2554. doi: 10.7150/ijbs.95122 综述 自噬的(正确)背景:分子基础、生物学相关性、药理学模式
1. 西班牙阿尔卡拉大学医学与健康科学学院医学与医学专科系,28801 阿尔卡拉德埃纳雷斯。 2. 拉蒙和卡哈尔卫生研究所 (IRYCIS),西班牙马德里 28034。 3. 西班牙阿尔卡拉大学医学与健康科学学院外科、医学与社会科学系,28801 阿尔卡拉德埃纳雷斯。 4. 阿尔卡拉大学系统生物学系(CIBEREHD)生物化学与分子生物学部,28801 阿尔卡拉德埃纳雷斯,西班牙 5. 阿斯图里亚斯王子大学医院普通外科和消化外科部,28805 阿尔卡拉德埃纳雷斯,西班牙。 6. 病理解剖学服务,马德里国防中央大学医院,28801 阿尔卡拉德埃纳雷斯,西班牙。 7. 免疫系统疾病-风湿病学、肿瘤科和内科(CIBEREHD),阿斯图里亚斯王子大学医院,28806 阿尔卡拉德埃纳雷斯,西班牙。
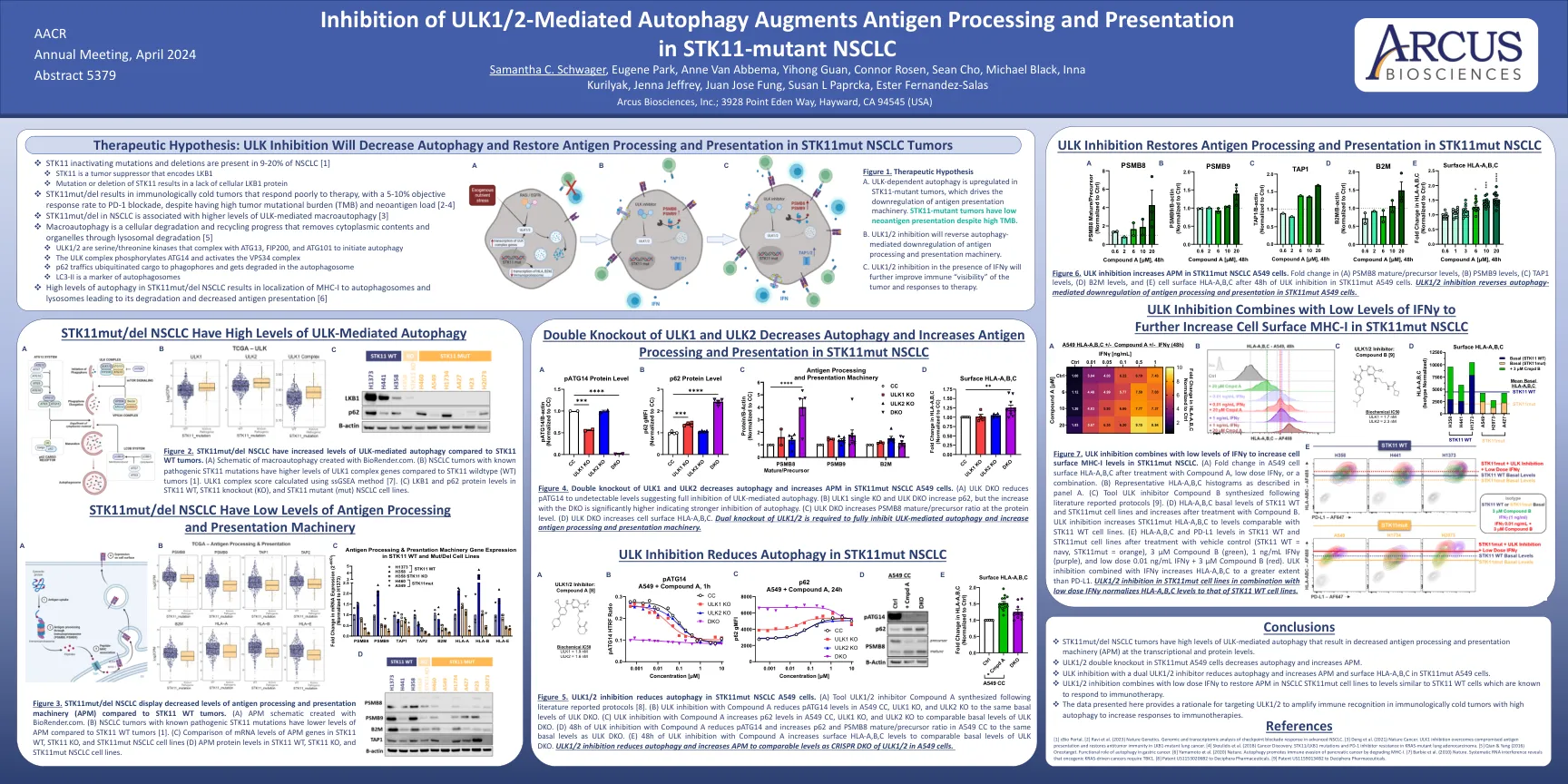
抑制ULK1/2介导的自噬增强抗原加工和表现 ARC-9:一项评估基于伊特鲁马德的治疗组合的随机研究
图2。与STK11 WT肿瘤相比, STK11MUT/DEL NSCLC具有ULK介导的自噬水平升高。 (a)用biorender.com创建的大噬细胞的示意图。 与STK11野生型(WT)肿瘤相比,具有已知致病性STK11突变的NSCLC肿瘤具有更高水平的ULK1复合基因[1]。 ULK1复合分数使用SSGSEA方法计算[7]。 (C)STK11 WT,STK11敲除(KO)和STK11突变体(MUT)NSCLC细胞系中的LKB1和P62蛋白水平。 图4。 ULK1和ULK2的双重敲除可降低自噬并增加STK11MUT NSCLC A549细胞中的APM。 (a)ULK DKO将PATG14降低至无法检测的水平,表明对ULK介导的自噬完全抑制。 (b)ULK1单个KO和ULK DKO增加了p62,但随着DKO的增加,dKO的增加表明自噬抑制更强。 (c)ULK DKO在蛋白质水平上增加了PSMB8成熟/前体比率。 (d)ULK DKO增加了细胞表面HLA-A,b,c。 需要ULK1/2的双重敲除以完全抑制ULK介导的自噬并增加抗原加工和表现机制。STK11MUT/DEL NSCLC具有ULK介导的自噬水平升高。(a)用biorender.com创建的大噬细胞的示意图。与STK11野生型(WT)肿瘤相比,具有已知致病性STK11突变的NSCLC肿瘤具有更高水平的ULK1复合基因[1]。ULK1复合分数使用SSGSEA方法计算[7]。 (C)STK11 WT,STK11敲除(KO)和STK11突变体(MUT)NSCLC细胞系中的LKB1和P62蛋白水平。 图4。 ULK1和ULK2的双重敲除可降低自噬并增加STK11MUT NSCLC A549细胞中的APM。 (a)ULK DKO将PATG14降低至无法检测的水平,表明对ULK介导的自噬完全抑制。 (b)ULK1单个KO和ULK DKO增加了p62,但随着DKO的增加,dKO的增加表明自噬抑制更强。 (c)ULK DKO在蛋白质水平上增加了PSMB8成熟/前体比率。 (d)ULK DKO增加了细胞表面HLA-A,b,c。 需要ULK1/2的双重敲除以完全抑制ULK介导的自噬并增加抗原加工和表现机制。ULK1复合分数使用SSGSEA方法计算[7]。(C)STK11 WT,STK11敲除(KO)和STK11突变体(MUT)NSCLC细胞系中的LKB1和P62蛋白水平。图4。ULK1和ULK2的双重敲除可降低自噬并增加STK11MUT NSCLC A549细胞中的APM。(a)ULK DKO将PATG14降低至无法检测的水平,表明对ULK介导的自噬完全抑制。(b)ULK1单个KO和ULK DKO增加了p62,但随着DKO的增加,dKO的增加表明自噬抑制更强。(c)ULK DKO在蛋白质水平上增加了PSMB8成熟/前体比率。(d)ULK DKO增加了细胞表面HLA-A,b,c。需要ULK1/2的双重敲除以完全抑制ULK介导的自噬并增加抗原加工和表现机制。