XiaoMi-AI文件搜索系统
World File Search System残留DNA测试
在生产生物药物(包括单克隆抗体,治疗蛋白和疫苗)的生产过程中,必须控制残留的宿主细胞DNA污染以可接受的水平,以避免潜在的安全风险,例如免疫原性和致癌性。通过准确和敏感的测试来证明宿主细胞DNA的减少或从细胞底物中去除,以量化这种杂质在过程中测试或释放药物时需要进行量化。开发和验证内部方法可能需要时间和资源,并可能增加监管风险。USP一般章<509>提供了一种经过验证的方法,可用于测量在大肠杆菌或中国仓鼠卵巢(CHO)细胞系中生产的重组治疗产物中残留的宿主细胞DNA。残留的宿主细胞DNA污染必须以可接受的水平进行控制,以避免潜在的安全风险,例如免疫原性和致癌性。
通过荧光光谱与CARS-PLS模型
非线性PAH及其独特的化学结构与PAH的致癌性密切相关。5的PHE衍生物是具有显着性致癌性的PAH,PHE已成为PAHS研究中的代表化合物。6土壤作为一种重要介质,负责超过90%的PHE环境负荷,这很难降低土壤,并且随着时间的积累,其毒性变得越来越强大。7 - 9土壤中PHE造成的污染不仅会阻碍其正常功能,还会导致农作物的产量降低和农业产品安全问题,最终将通过食物链对人体造成极大的严重伤害。10 - 12世界卫生组织的国际癌症研究所宣布了一类致癌物,已证明其在人体中的存在会导致单调细胞的损害,从而通过高浓度的自由基浓度,甚至会损害损害。13 - 15鉴于PHE造成的人类健康和土壤环境的巨大威胁,研究对土壤生态系统污染的PHE污染的监测非常重要。13 - 15鉴于PHE造成的人类健康和土壤环境的巨大威胁,研究对土壤生态系统污染的PHE污染的监测非常重要。
协议代码luajnivpc肿瘤组肺...
注意:•建议使用抗组胺药,H 2拮抗剂或PPI,抗染料和皮质类固醇来预防/最小化与输注相关的反应2,3•ISATUXIMAB干扰交叉匹配和红色血液细胞抗体筛查;如果可能的话,在开始治疗之前进行血型和筛查测试2,3•预防疱疹带状疱疹重新激活可能需要抗病毒预防4致癌性:未进行致癌性研究。 第二个主要恶性肿瘤包括皮肤,乳房血管肉瘤和骨髓增生性综合征的鳞状细胞癌,据报道用Isatuximab治疗的患者。 2,3诱变程度:没有发现生育能力:未发现妊娠的信息:尚未在孕妇或研究动物中研究Isatuximab。 人类IgG1已知可以越过胎盘屏障;因此,作为IgG1衍生的抗体,Isatuximab有望从母亲传播到胎儿。 基于其作用机理,暴露于Isatuximab可能会导致胎儿伤害(例如,免疫细胞耗竭,神经系统缺陷,骨密度降低和代谢性疾病)。 生育潜力的妇女应在治疗期间和最后剂量后至少5个月使用避孕。 2,3不建议母乳喂养,因为母乳的潜在分泌。 人类IgG存在于人类母乳中。 尚不清楚通过胃肠道暴露于母乳喂养婴儿的影响。 4注意:•建议使用抗组胺药,H 2拮抗剂或PPI,抗染料和皮质类固醇来预防/最小化与输注相关的反应2,3•ISATUXIMAB干扰交叉匹配和红色血液细胞抗体筛查;如果可能的话,在开始治疗之前进行血型和筛查测试2,3•预防疱疹带状疱疹重新激活可能需要抗病毒预防4致癌性:未进行致癌性研究。第二个主要恶性肿瘤包括皮肤,乳房血管肉瘤和骨髓增生性综合征的鳞状细胞癌,据报道用Isatuximab治疗的患者。2,3诱变程度:没有发现生育能力:未发现妊娠的信息:尚未在孕妇或研究动物中研究Isatuximab。人类IgG1已知可以越过胎盘屏障;因此,作为IgG1衍生的抗体,Isatuximab有望从母亲传播到胎儿。基于其作用机理,暴露于Isatuximab可能会导致胎儿伤害(例如,免疫细胞耗竭,神经系统缺陷,骨密度降低和代谢性疾病)。生育潜力的妇女应在治疗期间和最后剂量后至少5个月使用避孕。2,3不建议母乳喂养,因为母乳的潜在分泌。人类IgG存在于人类母乳中。尚不清楚通过胃肠道暴露于母乳喂养婴儿的影响。4
Microsoft PowerPoint - 外用药物的临床前安全性评估及相关_v2.pptx
局部给药(皮肤溃疡和烧伤应用,FDA 2006 年 6 月) – 指南包括毒理学指南,建议使用载体和假对照组、超过预期临床剂量的治疗倍数以及反映临床途径的给药 – 包括生物制剂的免疫原性评估 – 小分子“慢性伤口”指征的致癌性研究。对于其他药物,肿瘤促进模型和肿瘤风险(包括疤痕癌)的科学评估,因为这些化合物通常是生长因子
亚硝胺 EMEA-H-A5(3)-1490 - 评估报告
2.3.2. 样品制备程序 ................................................................................................ 26 2.3.3. 导致错误分析结果的潜在原因 .............................................................................. 28 2.3.4. 内标 .............................................................................................................. 29 2.3.5. 质谱检测设备的优势 ...................................................................................... 29 2.3.6. OMCL 中当前使用的方法 ............................................................................. 29 2.3.7. 分析方法的灵敏度 ............................................................................................. 30 2.3.8. 关于分析方面的讨论 ............................................................................................. 31 2.4. 在药品中检测到 N-亚硝胺时计算暴露患者风险的注意事项 ............................................................................................. 31 2.4.1. N-亚硝胺的背景暴露 ............................................................................................. 31 2.4.2. 2.4.3. N-亚硝胺的致突变性和致癌性 .......................................................................................... 37 2.4.4. 使用体外致突变性数据对 N-亚硝胺进行致癌性等级排序 ............................................................................................. 41 2.4.5. 计算人类超额风险的通用方法 ............................................................................................. 43 2.4.6. 流行病学研究文献综述 ............................................................................................................. 44 2.5. 确定 N-亚硝胺限量的方法 ............................................................................................. 48 2.5.1. 单个亚硝胺限量、多个 N -亚硝胺限量和短于寿命(LTL)方法 ............................................................................................................. 48 2.5.2. 没有足够物质特定数据的亚硝胺限量 ............................................................................................. 50 2.5.3.其他风险管理方法 ................................................................................................ 51 2.5.4. 比较设定限度的不同选项 .............................................................................. 52 2.6. 考虑进一步研究 .............................................................................................. 56 2.6.1. 考虑进一步进行非临床/临床研究 ...................................................................... 56 2.6.2. 考虑进一步进行流行病学研究 ...................................................................... 56 2.7. 与 CHMP 对含有四唑环沙坦类药物的意见的相关性 ............................................. 58
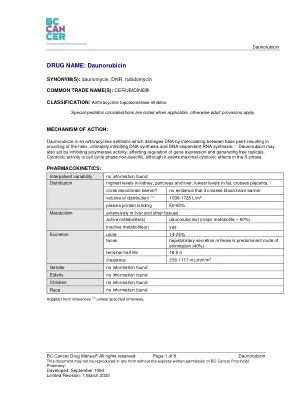
药物名称:daunorubicin
特殊预防措施:致癌性:潜在的致癌性;乳腺肿瘤和纤维肉瘤已在大鼠和小鼠模型中报道。1个次生白血病已经报道了接受拓扑异构酶II抑制剂与其他抗肿瘤剂或放射治疗的患者。在动物研究中,在测试受试者中观察到在动物研究中,腹膜肉瘤,乳腺癌和纤维肉瘤,剂量为基于BSA的剂量为1/70至2倍。5诱变性:AMES测试中的诱变和体外测试的哺乳动物。1个daunorubicin在体外和体内染色体测试中具有层生成性。生育能力:雄性狗的性腺抑制导致闭经,动物园和睾丸萎缩。6妊娠:在具有兔子的动物研究中,胎儿异常的发生率增加(例如,甲状腺皮质 - 枕骨颅骨,脐疝或rachischisis)以及以0.05 mg/kg/kg的剂量观察到的剂量(大约1/100 kg)(大约1/1/100 themunted the pepulence the Pusemented Humans剂量)。在大鼠中,肋骨融合率和食道,心血管和泌尿生殖器异常的发生率增加,每天4 mg/kg(约一半的基于BSA的建议人剂量的一半)观察到。在小鼠中观察到胎儿出生体重和递减后生长率的降低。5不建议母乳喂养,因为母乳的潜在分泌。6
1。药物链球菌的面额...
关于植物园Lanceolata L.干燥提取物的非临床数据,叶面不完整。由于它作为一种传统使用的药物的特性,因此有足够的证据表明人类安全使用。在细菌反向突变测试(AMES测试)上,在5株伤寒沙门氏菌上,没有与植物学的lanceolata L.干燥提取物相关的诱变剂潜力。尚未对繁殖的毒性和致癌性进行研究。除了在RCP的其他部分中所述的安全性之外,没有其他与评估安全性有关的信息(请参阅第4.6和4.9节)。
IS 4105 : 2023 苯乙烯(乙烯基苯)
在第三次修订中,删除了 2 级,因为全世界大多只生产一种等级,现有等级的苯乙烯要求修改为 99.7%(质量百分比)。修改了颜色、含量和硫含量的测定方法。此外,还纳入了用于测定相对密度、折射率、凝固点、醛、氯化物、抑制剂含量、聚合物含量和过氧化物的替代试验方法。苯具有致癌性,是苯乙烯中的杂质,委员会决定将苯作为特征,限量为 1 ppm。聚合物溶解度的要求已被删除,因为它已经以杂质的形式计算。