XiaoMi-AI文件搜索系统
World File Search Systemvai.au.a.p.-印度当代药品连词
c)规定的基本资格/经验是最低的,应在相应的邮政法规中提到的区域。仅拥有规定的基本资格/经验,就没有应有的候选人有权接受采访。正式组成的筛查委员会将采用其自己的标准,以便为候选人入围面试。因此,申请人应在其申请中的规定最低资格中提供所有相关信息,并由适当的文档支持。候选人必须确保所有信息都是完整而准确的。候选人申请了博士学位。建议(提交)包括其大学/机构适当当局发行的日期提交论文提交的有效记录证明。博士学位/硕士学位将从临时证书发出的日期/结果/授予日期的通知日期开始。候选人必须上传一页概要/摘要。 div>d论文/ M.Tech论文,无论适用。
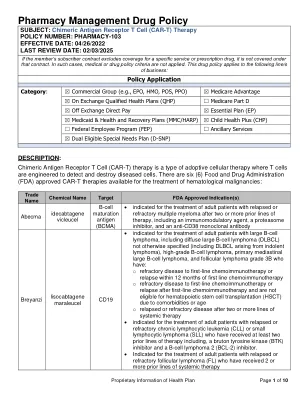
药房管理药品政策
描述:慢性阻塞性肺病 (COPD) 是一种异质性肺病,其特征是因气道异常(支气管炎、细支气管炎)和/或肺泡异常(肺气肿)导致持续、通常为进行性的气流阻塞而出现慢性呼吸道症状(呼吸困难、咳嗽、痰液产生和/或加重)。1 COPD 包括慢性支气管炎和/或肺气肿,这两种疾病都会使肺部空气排出逐渐变得更加困难。大多数 COPD 患者同时患有这两种疾病。COPD 最常见的症状是呼吸困难、慢性咳嗽和痰液产生。COPD 通常在 40 岁以上的成年人中诊断出来,患病率随着年龄的增长而增加。COPD 是由个体一生中发生的基因-环境相互作用引起的,这种相互作用会损害肺部和/或改变其正常发育/衰老过程。1 COPD 最常见的风险因素是吸烟。然而,其他风险因素包括空气污染、职业暴露、哮喘控制不佳、环境烟草烟雾、传染病和社会经济地位低下。2
药品赋形剂的最新进展为p- ...
药物赋形剂(如P-糖蛋白抑制剂)也可以增加药物对肠膜的溶解度和亲和力,增强细胞细胞途径和摄取内吞take虫,并激活淋巴转运途径,从而增加口服药物的生物利用度。本综述旨在通过评估P-糖蛋白流出蛋白在渗透性和药代动力学研究中评估P-糖蛋白外排的元数据来审查和评估药物赋形剂作为P-糖蛋白通透性抑制剂的性能。综述结果是药物赋形剂,已证明是来自表面活性剂和聚合物基团的P-糖蛋白抑制剂的有效,分别是TPGS和Poloxamer 188。与常规配方相比,所有将药物赋形剂掺入P-gp抑制剂的纳米系统都在提高口服药物的渗透性和生物利用度方面均具有潜力。这些系统的有效性已通过体外(CACO-2细胞),Ex Vivo(Ever the ted肠囊),原位(SPIP)和体内(AUC)方法评估。
根据全球基金质量保证政策分类的疟疾药品清单
专家审查小组(ERP):专家审查小组是由WHO基本药品和药品部门主持的外部技术专家组成的独立技术机构,旨在审查与未经Qualqualififififififice或SRA/WLA的使用相关的FPP相关的潜在风险/福利,或者允许允许其允许全球基金进行裁决。ERP审查的产品可以在有限的时间内(最多12个月)购买。 但是,在某些情况下,可以延长建议期。 与ERP审查产品的供应商/制造商的合同不应比该产品建议的有效期更长。 有关ERP流程和质量保证信息的详细信息,请参阅https://www.theglobalfund.org/en/sourcing-management/quality-assurance/。ERP审查的产品可以在有限的时间内(最多12个月)购买。但是,在某些情况下,可以延长建议期。与ERP审查产品的供应商/制造商的合同不应比该产品建议的有效期更长。有关ERP流程和质量保证信息的详细信息,请参阅https://www.theglobalfund.org/en/sourcing-management/quality-assurance/。
标准药品处方集
信息部分 IEHP 标准药物处方集是一份由美国食品药品管理局 (FDA) 批准并根据安全性、有效性和成本挑选出来的药物清单。这份仿制药和品牌药清单由您的健康保险单根据保单的处方药福利承保。承保的处方药包括: • FDA 批准的药物,根据加州或联邦法律需要处方。 • 胰岛素。 • 医疗需要时,用于注射胰岛素的笔式给药系统。 • 糖尿病检测用品,包括: o 刺血针。 o 刺血针穿刺装置。 o 血液和尿液测试条。 o 测试片剂。 • 美国预防服务工作组 (USPSTF) 评级为 A 或 B 的非处方药。 • 避孕药物和装置,包括: o 隔膜。 o 宫颈帽。 o 避孕环。 o 避孕贴。 o 口服避孕药。 o 紧急避孕药。 o 非处方避孕产品 • 医疗上必需的一次性设备,用于管理受保的门诊处方药,例如注射器和吸入器垫片。 如果您对药房承保范围有任何疑问,请致电 IEHP 会员服务部 1-855-433-4347(TTY 711),周一至周五,上午 8 点至下午 6 点。 定义 “年龄限制 (AL)”根据年龄限制药物的使用。 “上诉”是由会员或会员代表提出的书面或口头请求,要求重新评估计划或其任何授权实体(例如计划提供者)做出的特定决定。 “品牌药物”是以专有的商标保护名称销售的药物。品牌药物应全部以大写字母列出。 “共同保险”是指投保人在支付免赔额后支付的承保医疗保险费用的百分比,如果免赔额适用于医疗保险福利,例如处方药福利。“共付额”是指投保人在支付免赔额后支付的固定金额,如果免赔额适用于医疗保险福利,例如处方药福利。“免赔额”是指投保人在健康计划根据保单条款开始支付全部或部分医疗保险费用之前为承保医疗保险支付的金额。
药房管理药品政策
政策:肿瘤药物临床审查事先授权 (CRPA) 流程旨在确保在药物对会员和健康计划造成潜在功效、质量、毒性或使用问题的情况下,适当使用新批准的 (FDA) 处方药。此外,此政策还可用于存在重大安全性或不当使用问题但不需要单独制定政策的药物。药房管理临床团队根据临床审查事先授权 (CRPA) 流程审查属于这些类别的肿瘤药物。需要填写医疗必要性证明 (LOMN)、例外表格或事先授权表格,才能考虑根据此政策获得药物承保。此政策中列出的事先授权标准基于 FDA 标记的适应症或 NCCN 证据级别 1 或 2A。对于不符合以下定义的政策标准的请求,请参阅 FDA 批准药物的标签外使用政策。政策指南:
药房管理药品政策
• 用于治疗对一线化学免疫疗法有抵抗性或在一线化学免疫疗法后 12 个月内复发的大 B 细胞淋巴瘤成人患者 • 用于治疗经过两线或两线以上全身疗法治疗后复发或难治性大 B 细胞淋巴瘤成人患者,包括未另行指定的弥漫大 B 细胞淋巴瘤 (DLBCL)、原发性纵隔大 B 细胞淋巴瘤、高级别 B 细胞淋巴瘤和源自滤泡性淋巴瘤的 DLBCL • 用于治疗经过两线或两线以上全身疗法治疗后复发或难治性滤泡性淋巴瘤 (FL) 成人患者 本政策中列出的事先授权标准基于 FDA 标记的适应症或 NCCN 证据级别 1 或 2A。对于不符合下述政策标准的请求,请参阅 FDA 批准药物的标签外使用政策。政策指南:1. 随着新药的上市,本政策可能会经常修订。一些药物
对药品价格谈判的影响
a 研发成本取自各公司向美国证券交易委员会提交的报告。7 失败试验的支出和资本成本的估算方法与之前的研究相同。6 如果同时进行多种补充适应症(针对同一种药物)的试验,则根据患者入组人数按比例分配成本。
仔细阅读此页面 WA 药房质量保证委员会药房自检工作表 2025 年药品供应链安全法案 (DSCSA) - 可选
委员会(RCW 18.64.026(1))。以下附录完成后应保留在文件中。请勿发送到委员会办公室。此自我检查工作表的主要目标是提供机会评估是否遵守《药品供应链安全法》(DSCSA)的联邦要求。此工作表是遵守 DSCSA 联邦条款的起点。(注意:自我检查和委员会检查均不会评估您是否完全遵守所有药房执业法律和规则。)遵守 DSCSA 的最终责任在于每个制药公司和药房人员。自我检查完成日期:单击或点击输入日期。负责药房经理或同等级别经理的姓名:单击或点击此处输入文本。