XiaoMi-AI文件搜索系统
World File Search System社论:心脏健康与疾病中的蛋白质症
心血管疾病(CVD)是全球死亡的主要原因。过去几十年来,全球研究人员的努力令人振奋,以揭示CVD的基本分子机制。然而,直到最近才具有蛋白质稳态或蛋白质量作为关键细胞过程,在心力衰竭和心肌病的背景下引起了人们的注意(Wang and Robbins,2006)。蛋白质症涉及复杂且严格调节的过程,以平衡生产,折叠,交易和细胞蛋白的降解(Henning and Brundel,2017)。蛋白质合成和折叠由专门的系统(统称称为蛋白质质量控制(PQC))监测,其中伴侣,泛素 - 蛋白酶体系统(UPS),有时自动噬是作为中心参与者的。PQC损伤或不足可能会导致异常的蛋白质聚集,从而损害UPS并进一步增加蛋白毒性应激,这最终可能导致细胞死亡(Wang and Wang,2020年)。由于工作心肌细胞中极高的机械性,热和氧化应激,维持其蛋白质癌症尤其具有挑战性,但对于这些细胞和心脏的健康和功能至关重要(Henning and Brundel,2017年)。现在甚至被认为是大量心脏疾病子集的标志(Sanbe等,2004; Hofmann等,2019; Wang and Wang,2020)。但是,我们仍然远没有理解调节心脏蛋白质的确切机制。在此特别感兴趣的是UPS。与此一致,Trogisch等。本研究主题中文章的目的是阐明心脏中蛋白质的尚未发现的方面及其在心脏健康和疾病中的作用。UPS介导的蛋白水解是去除异常蛋白质的主要降解系统。已在几种人和实验性心脏病中报道了UPS的改变(Mearini等,2008; Schlossarek等,2014)。研究了20S蛋白酶体的LMP2是否缺乏LMP2,从而降低了蛋白酶体的可塑性,在慢性β-肾上腺素能刺激下撞击心脏重塑和功能,这是对心脏衰竭发展的主要贡献。虽然LMP2构成敲除(KO)小鼠的心脏功能在不挑战的条件下保持不变,但连续的β-肾上腺素能
嵌合抗原受体T细胞在多发性骨髓瘤不断发展的治疗景观中的作用:文献回顾
mm是最遇到的血液系统恶性肿瘤,总生存率较低[1]。它在浆细胞中产生,导致单克隆副蛋白的积累,导致骨破坏并导致末端器官损伤[2]。MM的经典表现包括高钙血症,贫血,肾功能衰竭,复发性细菌感染,裂解骨骼病变和外胸腔软组织浆细胞瘤[3]。 虽然疾病的发生率正在增加,但仍被认为是一种难以治愈的疾病。 尽管可用的治疗选择,例如免疫调节药物(IMID),蛋白酶体抑制剂(PIS)和其他单克隆抗体,但该疾病倾向于最终复发并复发,这进一步降低了预后[4]。 mm引起了大量的发病率和死亡率,这需要进一步研究以找到解决该疾病的解决方案[1,3]。MM的经典表现包括高钙血症,贫血,肾功能衰竭,复发性细菌感染,裂解骨骼病变和外胸腔软组织浆细胞瘤[3]。虽然疾病的发生率正在增加,但仍被认为是一种难以治愈的疾病。尽管可用的治疗选择,例如免疫调节药物(IMID),蛋白酶体抑制剂(PIS)和其他单克隆抗体,但该疾病倾向于最终复发并复发,这进一步降低了预后[4]。mm引起了大量的发病率和死亡率,这需要进一步研究以找到解决该疾病的解决方案[1,3]。
具有传染病的靶向蛋白质降解
摘要:靶向蛋白质降解(TPD)正在成为解决传染病的最具创新性策略之一。尤其是,依赖蛋白水解靶向嵌合体(Protac)介导的蛋白质降解可能比经典抗感染的小分子药物具有多种好处。由于其具有特殊和催化的作用机制,抗感染性Protac在疗效,毒性和选择性方面可能是有利的。重要的是,Protac还可以克服抗菌耐药性的出现。此外,抗感染的protac可能有可能(i)调节“不可能”的靶标,(ii)从经典药物发现方法中使用的“回收”抑制剂,以及(iii)组合疗法的新场景。在这里,我们试图通过讨论抗病毒protac和第一类抗菌Protac的选定案例研究来解决这些点。最后,我们讨论了如何在寄生疾病中利用Protac介导的TPD领域。由于尚未报道过抗寄生虫protac,因此我们还描述了寄生虫蛋白酶体系统。虽然处于起步阶段,并且在未来的许多挑战中,我们希望Protac介导的传染病蛋白质降解可能导致下一代抗感染药物的发展。关键字:靶向蛋白质降解,泛素蛋白酶体系统,protac,传染病,抗感染药物发现,病原体■简介
硼替佐米包裹的双响应共聚物...
胆囊癌 (GBC) 是一种罕见但恶性程度最高的胆道肿瘤。它通常在晚期才被诊断出来,常规治疗方法并不令人满意。作为蛋白酶体抑制剂,硼替佐米 (BTZ) 在 GBC 中表现出优异的抗肿瘤能力。然而,其长期治疗效果受到其耐药性、稳定性差和高毒性的限制。本文报道了 BTZ 封装的 pH 响应性雌酮共聚物纳米粒子 (ES-NP (BTZ; Ce6)) 用于 GBC 特异性靶向治疗。由于 GBC 中雌激素受体表达高,ES-NP (BTZ; Ce6) 可以通过 ES 介导的内吞作用迅速进入细胞并聚集在细胞核附近。在酸性肿瘤微环境 (TME) 和 808 nm 激光照射下,BTZ 被释放,Ce6 产生 ROS,从而破坏“反弹”反应通路蛋白,如 DDI2 和 p97,从而有效抑制蛋白酶体并增加细胞凋亡。与使用 BTZ 单药治疗的传统治疗相比,ES-NP (BTZ; Ce6) 可以在较低 BTZ 浓度下显著阻碍疾病进展并提高其耐药性。此外,ES-NP (BTZ; Ce6) 在患者来源的异种移植动物模型和其他五种类型的实体肿瘤细胞中表现出类似的抗肿瘤能力,揭示了其作为广谱抗肿瘤制剂的潜力。
BAG3 的治疗靶向:考虑到其复杂性......
简介现代医学面临的重要挑战是,新药、生物制剂甚至疫苗可能能够精确改变特定靶标的功能,但仍然具有脱靶效应,从而阻碍其治疗发展。当冲突涉及在心脏生理中发挥关键作用但同时促进癌症发展的蛋白质时,护理人员和患者都会面临挑战。一个很好的例子是,正在开发用于治疗心力衰竭 (HF) 的 Bcl2 相关的自噬基因-3 (BAG3) 激动剂和用于治疗癌症的 BAG3 抑制剂。癌细胞因代谢功能障碍、异常的 RNA 剪接、加速的蛋白质合成、代谢重编程以及错误折叠的蛋白质和其他细胞碎片的积累而受到高度压力。为了生存,癌细胞已经发展出增强蛋白酶体和自噬途径活性同时阻断细胞凋亡 (1) 的能力。因此,消除机体恶性肿瘤的合理策略是抑制蛋白质质量控制 (PQC) 并激活靶向凋亡 (2)。根据这一策略,癌细胞中积累的细胞碎片将被 BAG3 反应性促生存信号通路清除:自噬、线粒体自噬和泛素相关蛋白酶体通路 (3, 4)。不幸的是,开发 BAG3 靶向抗癌疗法的努力
对盐孢胺的结构见解介导的抑制人类20S蛋白酶体 组合的统计生物物理建模将离子通道基因与皮质神经元类型的生理学联系
。cc-by 4.0国际许可(未经Peer Review尚未获得认证)是作者/资助者,他已授予Biorxiv的许可证,以永久显示预印本。它是制作
抗 ICAM1 抗体-药物偶联物对多发性骨髓瘤的强效活性
多发性骨髓瘤是一种抗体产生性浆细胞的肿瘤性克隆扩增。在过去的 20 年中,IMiD(免疫调节药物)和蛋白酶体抑制剂已被证明对骨髓瘤有效,并且已将接受自体干细胞移植和来那度胺维持治疗的患者的总生存期延长至 10 年(1)。此外,单克隆抗体,尤其是达雷木单抗,对控制复发性疾病的能力做出了巨大贡献(2)。然而,对于大多数患者来说,骨髓瘤仍然无法治愈,并且不可避免地会对所有可用药物产生耐药性。当蛋白酶体抑制剂、IMiD 和达雷木单抗产生耐药性时,平均生存期变为 9 个月,并且仍然迫切需要新的治疗方法(3)。重要的是,在达雷木单抗治疗后,CD38 靶标从骨髓瘤细胞表面迅速下调(4),导致耐药性(5)。事实上,达雷木单抗耐药患者已成为骨髓瘤治疗发展的主要挑战。早期临床试验中特别有前景的是针对 BCMA 的下一代免疫疗法,包括嵌合抗原受体 T 细胞、双特异性 T 细胞结合抗体和抗体-药物偶联物,但初步数据表明,患者最终也会复发,并且对这些疾病也具有耐药性 (6-10)。
抗 ICAM1 抗体-药物偶联物对多发性骨髓瘤的强效活性
多发性骨髓瘤是一种抗体产生性浆细胞的肿瘤性克隆扩增。在过去的 20 年中,IMiD(免疫调节药物)和蛋白酶体抑制剂已被证明对骨髓瘤有效,并且已将接受自体干细胞移植和来那度胺维持治疗的患者的总生存期延长至 10 年(1)。此外,单克隆抗体,尤其是达雷木单抗,对控制复发性疾病的能力做出了巨大贡献(2)。然而,对于大多数患者来说,骨髓瘤仍然无法治愈,并且不可避免地会对所有可用药物产生耐药性。当蛋白酶体抑制剂、IMiD 和达雷木单抗产生耐药性时,平均生存期变为 9 个月,并且仍然迫切需要新的治疗方法(3)。重要的是,在达雷木单抗治疗后,CD38 靶标从骨髓瘤细胞表面迅速下调(4),导致耐药性(5)。事实上,达雷木单抗耐药患者已成为骨髓瘤治疗发展的主要挑战。早期临床试验中特别有前景的是针对 BCMA 的下一代免疫疗法,包括嵌合抗原受体 T 细胞、双特异性 T 细胞结合抗体和抗体-药物偶联物,但初步数据表明,患者最终也会复发,并且对这些疾病也具有耐药性 (6-10)。
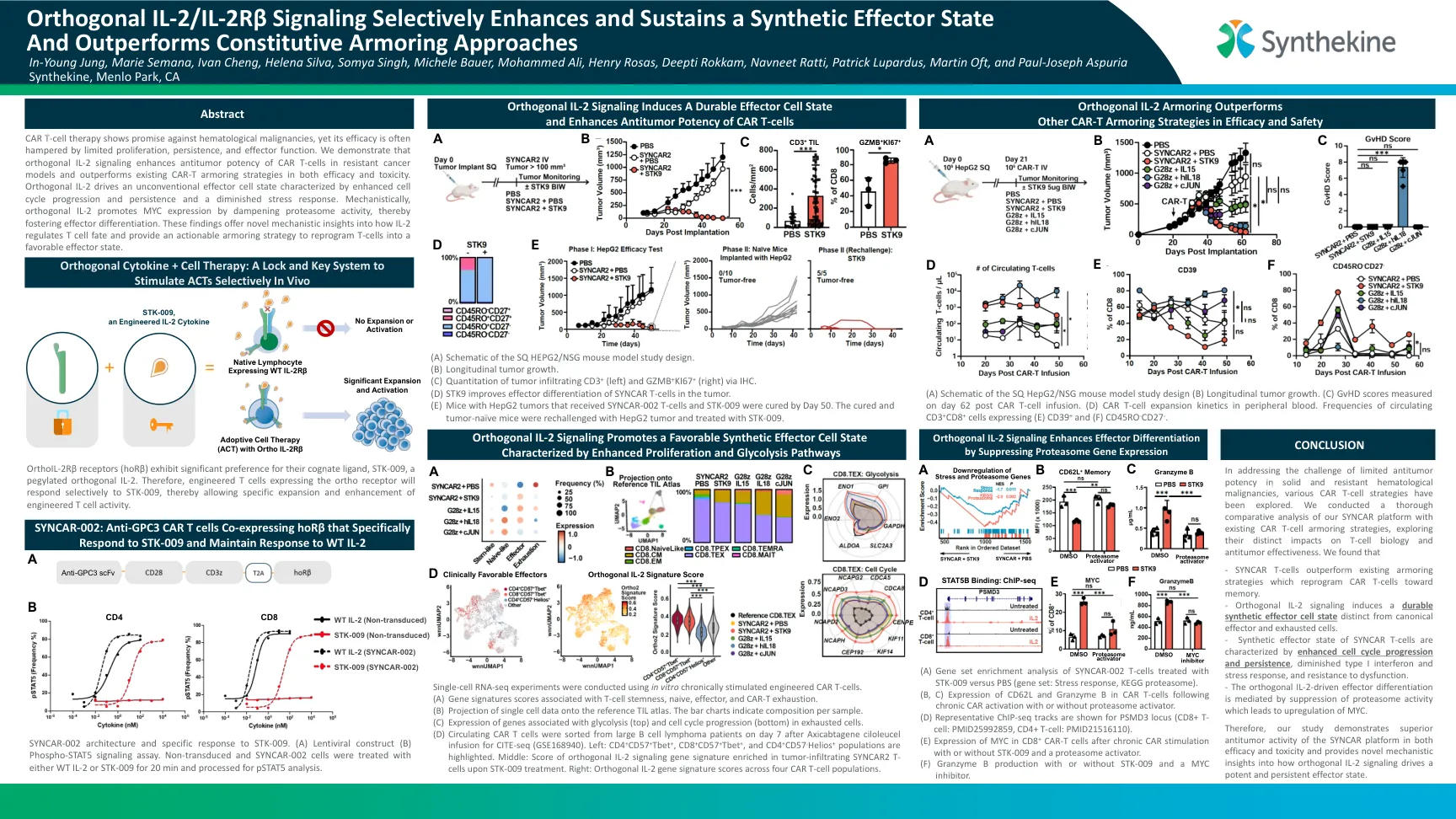
正交IL-2/IL-2Rβ信号有选择地增强和维持合成效应子状态,并且表现优于组成型装甲方法
CAR T细胞疗法表现出对血液学恶性肿瘤的有望,但其功效通常受到有限的增殖,持久性和效应子功能的阻碍。我们证明,正交IL-2信号传导在抗性癌症模型中增强了CAR T细胞的抗肿瘤效力,并且在功效和毒性中都胜过现有的CAR-T装甲策略。正交IL-2驱动非常规效应细胞态,其特征是细胞周期进展和持久性增强以及应力反应减少。 从机械上讲,正交IL-2通过抑制蛋白酶体活性促进MYC的表达,从而促进效应子分化。 这些发现提供了有关IL-2如何调节T细胞命运的新型机械见解,并提供了可行的装甲策略,以将T细胞重编程为有利的效应子状态。正交IL-2驱动非常规效应细胞态,其特征是细胞周期进展和持久性增强以及应力反应减少。从机械上讲,正交IL-2通过抑制蛋白酶体活性促进MYC的表达,从而促进效应子分化。这些发现提供了有关IL-2如何调节T细胞命运的新型机械见解,并提供了可行的装甲策略,以将T细胞重编程为有利的效应子状态。