XiaoMi-AI文件搜索系统
World File Search System去泛素化酶USP1在结直肠癌细胞中被ML323自动泛素化和不稳定
目标:我们先前的研究表明,USP1抑制剂ML323在结直肠癌(CRC)细胞中下调了USP1,但特定机制仍然未知。方法:将CRC细胞裂解以进行免疫印迹以检测蛋白质表达。定量实时PCR进行检查以检查mRNA水平。进行了环己酰亚胺追逐测定法,以评估USP1的半衰期。共沉淀用于分析USP1的多泛素化。结果:CRC细胞中蛋白酶体抑制剂MG132增强了USP1蛋白稳定性。野生型USP1被MG132上调,但没有其催化突变体。此外,MG132也增强了USP1的多泛素化,这表明USP1通过泛素蛋白蛋白酶体途径降解。同时,我们证实ML323在CRC细胞中下调了USP1的表达,并且环己酰亚胺追逐测定也显示ML323降低了USP1蛋白质的稳定性。进一步的结果表明,MG132消除了ML323诱导的USP1下调和不稳定。此外,caspase抑制剂Z-VAD并未逆转USP1蛋白的不稳定,这进一步表明ML323诱导的USP1下调并不取决于CRC细胞中细胞死亡的影响。结论:我们的结果表明USP1是自动泛素化的,ML323通过CRC细胞中的泛素蛋白酶体途径不稳定USP1,为抗CRC药物的开发提供了针对USP1的理论基础。关键字:大肠癌,USP1,ML323
实现药物发现的目标
3D 结构解答您的生物学问题 借助 Tundra Cryo-TEM,您可以以生物学相关的分辨率验证您的生物化学工作,以显示在接近天然条件下大型动态蛋白质系统中蛋白质、小分子和翻译后修饰之间相互作用的结构细节。这些分子细节证实了复杂生物系统(例如膜蛋白、蛋白质复合物和大分子机器,如病毒、核糖体和蛋白酶体)对人类健康和疾病的作用机制。Tundra Cryo-TEM 可以生成分辨率高达 3.4 Å 的 GABA A 受体结构和 3.0 Å 的 T20S 蛋白酶体结构。在这种细节级别上,可以看到许多重要的生物学细节,例如抗体或纳米抗体的结合(这对于表位图谱至关重要)、蛋白质-蛋白质复合物形成和相互作用的分子细节、小分子的结合或病毒-受体相互作用。这种高分辨率图谱允许从头构建模型,并可以帮助科学家了解蛋白质如何发挥作用、如何修改基因以及如何相应地设计药物。
欧洲布鲁顿酪氨酸激酶抑制剂治疗失败后复发/难治性套细胞淋巴瘤患者的真实世界经验:SCHOLAR-2 回顾性图表审查研究
对于复发/难治性 (R/R) MCL,目前尚无广泛适用的标准治疗方法,因此这些患者的治疗选择受年龄、体能状态、合并症和既往治疗的影响。1 治疗选择包括共价布鲁顿酪氨酸激酶抑制剂 (BTKi)、细胞毒性化疗、免疫调节药物、蛋白酶体抑制剂、哺乳动物雷帕霉素靶点抑制剂和同种异体干细胞移植。1,2,7 在美国,较新获批的药物包括硼替佐米(蛋白酶体抑制剂)、来那度胺(免疫调节剂)、伊布替尼 (BTKi)、阿卡替尼 (BTKi) 和赞布替尼 (BTKi)。目前,BTKis 是 R/R MCL 中最常用的药物类别;然而,对在 BTKi 暴露期间或之后病情进展的患者的早期观察显示,患者的生存率极低,后续选择非常有限。8–11
通过无标记富集和重组基因工程位点 (MERGE) 实现快速、可扩展的组合基因组工程
‡ 通信地址:aashiq.kachroo@concordia.ca 关键词:基因组工程、CRISPR-Cas9、人源化酵母、蛋白酶体 缩写:CFU、菌落形成单位;DSB、双链断裂;HDR、同源定向 DNA 修复;HR、同源重组;CELECT、基于 CRISPR-Cas9 的选择以丰富基因型;MERGE、无标记富集和重组基因工程位点;SGA、合成遗传阵列
通过无标记富集和重组基因工程位点 (MERGE) 实现快速、可扩展的组合基因组工程
‡ 通信地址:aashiq.kachroo@concordia.ca 关键词:基因组工程、CRISPR-Cas9、人源化酵母、蛋白酶体 缩写:CFU、菌落形成单位;DSB、双链断裂;HDR、同源定向 DNA 修复;HR、同源重组;CELECT、基于 CRISPR-Cas9 的选择以丰富基因型;MERGE、无标记富集和重组基因工程位点;SGA、合成遗传阵列
螺环候选 ADRM1/RPN13 抑制剂 Up284 的开发和抗癌特性
硼替佐米已成功治疗多发性骨髓瘤,但对实体瘤无效,神经病变、血小板减少症和耐药性的出现等毒性促使人们努力寻找替代的蛋白酶体抑制剂。双苄基哌啶酮(如 RA190)共价结合 ADRM1/RPN13,这是一种泛素受体,支持识别蛋白酶体的多泛素化底物及其随后的去泛素化和降解。虽然这些候选 RPN13 抑制剂 (iRPN13) 在小鼠癌症模型中显示出有希望的抗癌活性,但它们的类药物特性并不理想。在这里,我们描述了 Up284,一种新型候选 iRPN13,它具有一个中心螺碳环,代替了 RA190 有问题的哌啶酮核心。来自不同癌症类型(卵巢癌、三阴性乳腺癌、结肠癌、宫颈癌和前列腺癌、多发性骨髓瘤和胶质母细胞瘤)的细胞系对 Up284 敏感,包括几种对硼替佐米或顺铂有抗性的细胞系。Up284 和顺铂在体外表现出协同细胞毒性。Up284 诱导的细胞毒性与线粒体功能障碍、活性氧水平升高、极高分子量多泛素化蛋白质聚集体的积累、未折叠蛋白质反应和细胞凋亡的早期发生有关。Up284 和 RA190,但不是硼替佐米,在体外增强了抗原呈递。Up284 在数小时内从血浆中清除,并在 24 小时内在主要器官中积聚。单剂量 Up284 经腹膜内或口服给药于小鼠,可抑制肌肉和肿瘤中的蛋白酶体功能,持续时间超过 48 小时。在重复剂量研究中,小鼠对 Up284 的耐受性良好。Up284 在异种移植、同源和基因工程小鼠卵巢癌模型中表现出治疗活性。
JONAS, SCHWESTERMANN 主要研究领域
多发性骨髓瘤 (MM) 是一种在骨髓中积聚的浆细胞恶性肿瘤,是最常见的血液系统恶性肿瘤之一。蛋白酶体抑制剂 (PI) 已成为 MM 治疗的支柱,并显著有助于改善患者的预后。然而,绝大多数骨髓瘤患者最初对基于 PI 的疗法有反应,但在疾病过程中会产生耐药性,最终死于 PI 耐药性 MM。因此,为 PI 耐药性 MM 患者寻找有效的治疗方法是一项尚未满足的临床需求。人们对 PI 耐药性 MM 的体内生物学了解甚少,而且我们缺乏针对 PI 耐药性 MM 潜在机制的治疗方法。我们假设,在体内蛋白酶体抑制的长期选择压力下,骨髓微环境会改变 MM 浆细胞群的特性,以抵御蛋白酶体抑制的细胞毒作用。我们进一步假设,这些变化从根本上不同于 PI 敏感细胞,并使它们进化出难治性 MM 患者中常见的特征。该项目的目的是使用原位 MM 小鼠模型,通过单细胞 RNA 测序 (scRNA-Seq) 剖析人类 MM 细胞暴露于第二代 PI 卡非佐米 (CFZ) 后转录变化的分子景观。为此,我们将比较从 a) 体外、b) 活跃生长期间的体内(未处理)和 c) 体内(一旦 MM 细胞对 CFZ 治疗产生耐药性)获得的样本。最后,我们旨在确定赋予 MM 骨髓介导的 PI 抗性的特定基因和通路,从而可能提供潜在的治疗靶点。基于 scRNA-Seq 的结果,我们将在第二步进行 CRISPR-Cas9 功能丧失基因编辑,以验证先前确定的靶标是否与体内 CFZ 抗性有关,目的是发现目前 FDA 批准药物的新治疗方法(药物再利用)。该项目的结果可能会大大推进目前对 MM 中 PI 抗性的生物学知识。
病理骨料的定量超分辨率成像揭示了不同突触核苷的明显毒性曲线
蛋白质聚集是主要神经退行性疾病的标志。增加的数据表明,较小的聚集体会导致毒性反应高于纤维骨料(纤维)。但是,小骨料的大小对它们在生物逻辑相关的环境中的检测提出了质疑。在这里,我们报告了在活细胞和离体脑组织中定量超级分解的方法。我们表明,Amytracker 630(AT630)是一种商业聚集的流体载体,具有出色的光物理特性,可实现α-羟基核蛋白,tau和淀粉样蛋白β骨料的超分辨率成像,实现〜4 nm nm precision。将AT630应用于App NL-G-F小鼠脑部或从帕金森氏病供体中提取的聚集体,我们与特定于淀粉样β或α-突触核蛋白的抗体表现出了极好的一致性,并证实了特定于630的特定城市。随后,我们使用AT630揭示了α-突触核蛋白骨料大小和细胞毒性之间的线性关系,并发现小于450±60 nm的聚集体很容易穿透质膜。我们确定六种帕金森氏病和痴呆症中的450nm浓度,并带有路易体供体样品,并表明在不同的突触核苷酸中的聚集体在毒性上表现出明显的效力。我们进一步表明细胞渗透聚集体被蛋白酶体包围,这些蛋白酶体将蛋白酶体包含在焦点中,以逐渐形成骨料。我们的结果表明,质膜有效地填充了纤维,但容易受到450±60 nm骨料的渗透。一起,我们的发现提出了一种令人兴奋的策略,以确定异质样本中总体毒性的特定毒性。我们在生物环境中定量测量这些有毒骨料的方法为生理条件下的疾病机制的分子检查打开了可能性。
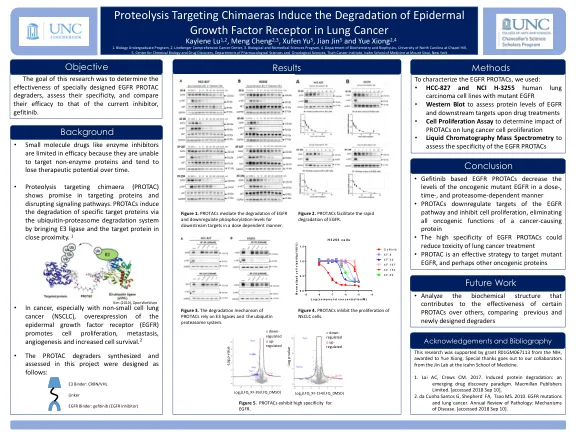
针对嵌合体的蛋白水解诱导表皮细胞的降解
• 基于吉非替尼的 EGFR PROTAC 以剂量、时间和蛋白酶体依赖的方式降低致癌突变 EGFR 的水平 • PROTAC 下调 EGFR 通路的靶点并抑制细胞增殖,消除致癌蛋白的所有致癌功能 • EGFR PROTAC 的高特异性可以降低肺癌治疗的毒性 • PROTAC 是针对突变 EGFR 和其他致癌蛋白的有效策略