XiaoMi-AI文件搜索系统
World File Search System监测,预防和治疗接受双特异性抗体治疗的MM患者的感染:专家小组的共识建议。
双科抗体(BSABS)正在成为一种重要的新型免疫治疗剂,用于治疗多发性骨髓瘤(MM),并将在临床实践中更广泛地使用。然而,这种新的疗法与包括细胞因子释放综合征和免疫效应细胞相关的神经毒性综合征以及AES的明显不良事件(AE)相关,以及导致诸如细胞质和低>远母努氏症的感染风险增加的AES,以及增加的感染风险。显示出感染的风险增加。本评论在2022年8月举行的会议之后,提供了由13个全球专家组成的小组的共识建议。会议的目标是审查现有文献,并确定有关MM患者所有BSAB的感染的相关信息,并讨论管理这些感染的专家的临床经验。此处概述的建议可用于指导感染危险因素的管理,例如低磁性血症和中性粒细胞减少症。此外,它们可用于指导细菌,病毒和真菌感染的监测,预防和治疗,包括新兴感染感染,例如冠状病毒2019(COVID-19),以及在BSAB治疗之前和期间使用疫苗的使用。建议根据可用数据级别对小组进行了分级。Key recommendations include universal herpes simplex and varicella zoster virus prophylaxis, screening for hepatitis B virus reactivation risk in all patients, monthly intravenous immunoglobulin treatment for immunoparesis and in the absence of life- threatening infectious manifestations, use of colony-stimulating factors in patients with Grade 3 neutropenia, universal pneumocystis jirovecii预防肺炎,没有常规的抗真菌预防。
sitc2024-t-cell-engager-release_110724- ...
剑桥,马萨诸塞州 - 2024年11月7日 - 临床阶段的生物技术公司Nextpoint Therapeutics,开发了针对新的精确免疫肿瘤学和针对肿瘤指导的新型B7-H7 Axis的治疗学,今天在癌症中宣布了3年度的3年度招待会(39年度),在39年度举行3年度的年度招待会上,这是39年的年度介绍,德克萨斯州。基于对B7-H7轴的深刻生物学理解,NextPoint开发了一系列B7-H7靶向双特异性CD3参与抗体(BSABS)。这些BSAB被设计为结合在肿瘤细胞表面和T细胞表面表达的B7-H7,以诱导有效的T细胞介导的细胞毒性对B7-H7+肿瘤,而与现有的ADC/IO方法无关。NextPoint的B7-H7XCD3 BSAB 2:1双特异性抗体设计提供了优化的目标:CD3亲和力比,灭活FC效应器函数以及完全评估安全性的能力。由于正常组织表达非常有限,B7-H7XCD3可以安全地施用。在SITC中提供的功效数据表明,除了在大多数B7-H7+肿瘤轴承小鼠中诱导了完全回归外,还针对多个B7-H7+肿瘤细胞系具有有效的T细胞介导的细胞毒性。“靶向B7-H7是一种在正常组织表达受限的癌细胞中高度上调的新型肿瘤抗原,是治疗实体瘤的新领域。B7-H7指示T细胞参与者有可能克服复杂的肿瘤微环境并驱动耐用的抗肿瘤反应。“ Nextpoint的T细胞Endagers在B7-H7阳性细胞接近T细胞的精确激活,并在体外和体内研究中结合其有效的抗肿瘤活性,支持我们发展有效和有针对性的B7-H7免疫治疗的愿景。在多个动物模型中的体内完全回归是有效性的令人印象深刻的迹象,表明B7-H7靶向BSAB将推动癌症治疗的界限,并成为我们阿森纳的强大工具,以针对一组新的B7-H7生物标志物,确定了固体恶性肿瘤的患者。武装着耐受性数据,NextPoint正在迅速推进我们的T细胞参与者NPX372的研究新药(IND)申请。我们期待将这种创新的方法推向B7-H7生物标志物分析支持的临床开发,以丰富响应者。”演示详细信息:标题:B7-H7-CD3双特异性T细胞参与抗体在B7-H7+临床前肿瘤模型中表现出有效的抗肿瘤活性摘要:1318日期和时间:2024年11月9日,星期六,上午9:00,上午7:00
简介方法结果
缩写:1L,第一行; 2L,第二行; BC,乳腺癌; BSAB,双特异性抗体; BTC,胆道癌; CCR8,C-C基序趋化因子受体8; CRC,结直肠癌; DGKζ,二酰基甘油激酶ζ; GC,胃癌; GEA,胃食管腺癌; HER2,人表皮生长因子受体2; HNSCC,头和颈部鳞状细胞癌HPK1,造血祖细胞激酶1; lag3,淋巴细胞激活基因3; LS-SCLC,有限阶段的小细胞肺癌; MBC,转移性乳腺癌; MSS,微卫星稳定性; OX40,肿瘤坏死因子(TNF)受体家族的成员,也称为CD134。 RCC,肾细胞癌; r/r,复发/耐火; SCLC,小细胞肺癌; SMAC,第二个线粒体衍生的caspase激活剂; TIM3,T细胞免疫球蛋白结构域和粘蛋白结构域3; UC,尿路上皮癌。
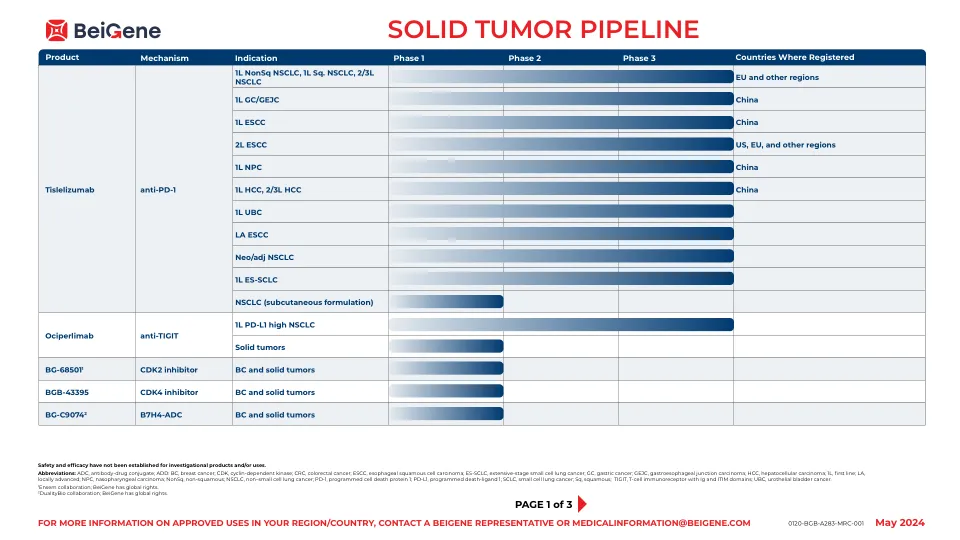
实体瘤管道
缩写:1L,第一行; 2L,第二行; 3L,第三行; 4-1BB,肿瘤坏死因子受体超家族成员9; ADC,抗体 - 药物结合; BSAB,双特异性抗体; CCR8,C-C基序趋化因子受体8; CD16A,FC受体FCγRIIIA; CD3,分化3群; CDAC,嵌合降解激活化合物; CEA,癌脑抗原; DGKζ,二酰基甘油激酶ζ; DLL3,类似三角洲的配体3; EGFR,表皮生长因子受体; ES-SCLC,广泛的小细胞肺癌; FGFR2B,成纤维细胞生长因子受体2,同工型IIIB; GBRCAM,种系乳腺癌基因(BRCA)突变;胃肠道,胃肠道; GPC3,Glypican-3; IL-15,白介素15; Kras,Kirsten大鼠肉瘤病毒; LS-SCLC,有限阶段的小细胞肺癌; MCRPC,转移性cast割前列腺癌; MTX,维护处理; MUC1,粘蛋白1; PARP 1/2,聚(ADP-核糖)聚合酶1和2; PRMT5,蛋白精氨酸甲基转移酶5; PSOC,铂敏感的卵巢癌; SCLC,小细胞肺癌; STEAP1,前列腺1的六跨膜上皮抗原。
创新药物为癌症患者带来连续的好处
基于抗体的药物靶向并通过诸如ADCC,凋亡诱导,毒素结合,生长信号破坏和血管生成抑制等机械性抑制肿瘤生长。PD-L1抗体Envafolimab不仅增强了患者的依从性,而且与常规的PD-L1单克隆抗体并列时,可以显着提高生活质量。这项创新开辟了癌症免疫疗法的新途径。有希望的sabatolimab针对TIM3,已获得FDA快速批准用于MDS治疗。3 BSAB的快速增殖扩大了目标范围。目前,临床试验正在评估其与azacitidine结合使用的功效。在此类别中的显着候选人,例如莫斯·图祖马布,cadonilimab,amivantamab和teclistamab,在患者的无进展生存期间表现出显着的扩展,从而进一步证明了其效果。这些药物具有未来增长的巨大潜力,为可能耗尽传统治疗选择的癌症患者提供了希望。
首创双特异性抗体-药物偶联物 (DM002),靶向 HER3 和 MUC1 的近膜结构域
尽管新的抗癌药物不断进入市场,但 2021 年全球仍有超过 1000 万人死于癌症 1 ,其中肺癌、胃癌、乳腺癌和胰腺癌是中国和美国癌症相关死亡人数最多的疾病 2,3 。因此,迫切需要改进治疗干预措施。抗体-药物偶联物 (ADC) 是一种新型药物,它利用单克隆抗体对癌细胞上表达的靶抗原的特异性,以实现强效细胞毒性有效载荷的靶向递送。最近,已经开发出针对两种肿瘤相关抗原 (TAA) 的双特异性 ADC (BsADC),以进一步与其他目前可用的 HER3 mAb 一起扩增肿瘤 c。随后将这些 bsAb 通过蛋白酶可裂解的连接体与单甲基金圣草 E (MMAE) 结合,以获得一流的 BsADC 候选药物 DM002。 DM002 候选药物在肺癌、乳腺癌、胃癌和胰腺癌的多种 CDX 和 PDX 模型中表现出强大的抗肿瘤活性;最值得注意的是,DM002 候选药物在 BP0508 肺癌 PDX 模型中的表现优于基准 ADC。总之,这些数据表明 DM002 将成为 HER3 和 MUC1 同时表达肿瘤患者的有前途的治疗药物。
挽救疗法包括用 BCMA 进行再治疗……
抗骨髓瘤治疗前景。1 这些发现促使美国食品药物管理局 (FDA) 批准 2 BCMA 靶向的 CAR-T 疗法,idecabtagene vicleucel (ide-cel) 和 ciltacabtagene auto-leucel (cilta-cel),用于已接受 ≥ 4 种先前治疗 (LOT) 的三类暴露于 R/R MM 的患者。2、3 虽然可以获得高反应率和深度缓解,但这些疗法后经常出现复发。目前,对于 BCMA 靶向的 CAR-T 疗法后出现进行性疾病 (PD) 的 R/R MM 患者的预后和最佳治疗方法的了解有限。先前的研究表明,对于该患者群体,后续挽救疗法的总体反应率 (ORR) 较低且反应持续时间较短。 4、5 鉴于 FDA 最近批准了 BCMA 靶向双特异性抗体 (BsAb),包括 teclistamab 和 elranatamab,以及商业 BCMA 靶向 CAR-T 插槽的可用性逐渐增加,使用 BCMA 靶向药物进行再治疗可能是一种可能的治疗策略。目前,关于 BCMA 靶向 CAR-T 治疗后后续 BCMA 靶向疗法的疗效数据有限。在本研究中,我们分析了我们机构中接受 BCMA 靶向 CAR-T 治疗的 R/R MM 患者,并特别研究了 CAR-T 复发后的临床结果和挽救疗法的疗效,包括重复使用 BCMA 靶向疗法。
针对CD20的癌症免疫疗法的进展
CD20 主要位于 B 细胞上,在 B 细胞的发育、分化和激活中起着至关重要的作用,是治疗 B 细胞恶性肿瘤的关键治疗靶点。针对 CD20 的单克隆抗体的突破,尤其是利妥昔单抗,彻底改变了 B 细胞恶性肿瘤的预后。利妥昔单抗已获批用于治疗各种血液系统恶性肿瘤,标志着癌症治疗的范式转变。在当前情况下,针对 CD20 的免疫疗法继续快速发展。除了传统的 mAb 之外,进展还包括抗体-药物偶联物 (ADC)、双特异性抗体 (BsAbs) 和嵌合抗原受体修饰 (CAR) T 细胞。ADC 将抗体的精确性与药物的细胞毒性潜力相结合,为增强治疗效果提供了一条有希望的途径。BsAb,特别是 CD20xCD3 构建体,可重定向细胞毒性 T 细胞以消除癌细胞,从而提高其治疗作用的精确度和效力。CAR-T 细胞是对抗血液系统恶性肿瘤的一种有前途的策略,代表了真正个性化的治疗干预措施之一。目前,许多新疗法正在临床试验中进行评估。本综述是对 CD20 靶向疗法的全面总结,强调了持续存在的进展和挑战。尽管取得了重大进展,但与这些疗法相关的不良事件和耐药性的产生仍然是关键问题。了解和缓解这些挑战对于 CD20 靶向免疫疗法的持续成功至关重要。
多发性骨髓瘤双特异性抗体:靶点、药物、临床试验和未来方向的回顾
多发性骨髓瘤 (MM) 是一种浆细胞恶性肿瘤,是成人中第二常见的血液肿瘤,占所有癌症的 1.8%。在美国,MM 每年的发病率约为 30,770 例,死亡率很高,每年导致 12,770 人死亡。MM 是一种遗传复杂、高度异质性的恶性肿瘤,患者之间和患者内的克隆变异性显著。近年来,MM 的诊断、分类和治疗取得了显著的进步。然而,高危患者尚未从治疗进展中受益。高危患者通常对治疗有原发性耐药性或早期复发,最终导致进展为侵袭性终末期 MM,并伴有髓外疾病或浆细胞白血病。因此,需要新的治疗方式来改善这些患者的预后。双特异性抗体 (BsAbs) 是一种免疫治疗剂,可同时靶向并因此将效应免疫细胞重定向至肿瘤细胞。BsAbs 在 B 细胞恶性肿瘤(包括难治性/复发性急性淋巴细胞白血病)中表现出很高的疗效。目前,针对 MM 特异性抗原(例如 B 细胞成熟抗原 (BCMA)、CD38 和 CD138)的各种 BsAbs 正处于临床前和临床开发阶段,并取得了令人鼓舞的结果。在这篇综述中,我们概述了这些进展,重点介绍了 BsAb 药物、其靶标及其改善生存率的潜力,尤其是对于高风险 MM 患者。结合目前的治疗策略,BsAbs 可能为治愈 MM 铺平道路。
B 细胞非霍奇金淋巴瘤的 T 细胞重定向疗法
过去二十年,B 细胞非霍奇金淋巴瘤 (B-NHL) 治疗取得了几项关键进展,这些进展战略性地利用了适合免疫疗法靶向的 B 细胞谱系标记。首先,将抗 CD20 单克隆抗体 (mAb) 利妥昔单抗添加到一系列标准疗法中,在不同情况下带来了显著的疗效改善,其中最突出的可能是新诊断的弥漫性大 B 细胞淋巴瘤 (DLBCL) 的总体生存优势。随后,多种针对 CD19 的嵌合抗原受体 (CAR) T 细胞疗法彻底改变了复发/难治性 (rel/ref) DLBCL 的治疗,并且也适用于其他 B-NHL 亚型。最近,利用患者内源性 T 细胞对抗淋巴瘤的长期愿望已经通过 T 细胞重定向疗法实现,例如双特异性抗体 (BsAb),其结合了对肿瘤表达的 T 细胞抗原(例如 CD3)和 B 细胞抗原(例如 CD19 或 CD20)的双重靶向。这些新型药物作为单一疗法在接受过大量治疗的多种亚型 B-NHL 患者中表现出令人印象深刻的活性。现在,无数临床试验正在探索 T 细胞重定向剂与靶向疗法、抗体-药物偶联物、常规化疗甚至新免疫疗法的组合。在这里,我们重点介绍了用于治疗 B-NHL 的 T 细胞重定向疗法发展的关键里程碑、最近临床试验的新证据和经验教训以及该领域令人兴奋的新方向。