XiaoMi-AI文件搜索系统
World File Search Systemadavosertib增强了曲妥珠单抗deruxtecan在HER2表达癌症中的抗肿瘤活性
摘要◥目的:Cyclin E(CCNE1)被提议为敏感性Toadavosertib的生物标志物,Toadavosertib是一种WEE1激酶抑制剂,ANDA对HER2靶向治疗的抗性机制。实验设计:分析了来自癌症基因组图集和MD Anderson癌症中心数据库的拷贝数和基因组测序数据,以评估ERBB2和CCNE1表达。通过下一代测序,全异位测序,含量的原位杂交 - IHC评估肿瘤和患者衍生异种移植物(PDX)的分子特征(PDX)。在体外,CCNE1过表达或在HER2三细胞系中击倒,以评估药物组合效率。在体内,携带PDX的NSG小鼠与各种治疗方案进行了联合治疗,然后进行肿瘤生长评估。PDX中的药效标记是由IHC和反相蛋白阵列的特征。 结果:在几种ERBB2癌症中,CCNE1共体得到了鉴定(胃肠道37%,内测原43%和PDX中的药效标记是由IHC和反相蛋白阵列的特征。结果:在几种ERBB2癌症中,CCNE1共体得到了鉴定(胃肠道37%,内测原43%和
HER2 阳性乳腺癌的曲妥珠单抗耐药性
曲妥珠单抗是人类表皮生长因子受体2(HER2)阳性乳腺癌的标准分子靶向治疗方法,可显著提高该分子亚型乳腺癌患者的生存期。然而,临床上曲妥珠单抗的起效或继发性耐药问题限制了其疗效。因此,探讨曲妥珠单抗耐药机制并制定应对措施具有重要意义。本研究阐述了曲妥珠单抗耐药的潜在分子机制,包括ERBB2突变和核定位、ERBB2的转录和翻译后改变、旁路信号通路的过度激活等,并总结出可能出现的预测曲妥珠单抗耐药的生物标志物和治疗策略,以期为逆转曲妥珠单抗耐药提供研究方向。
肿瘤内在亚型和基因表达特征...
结果 在汇总分析中,758 名女性的中位年龄为 49 岁,12% 为亚裔,6% 为黑人,75% 为白人。总体而言,pCR 结果与 ERBB2 富集(风险比 [HR],0.45;95% CI,0.29-0.70;P < .001)和基底样(HR,0.19;95% CI,0.04-0.86;P = . 03)亚型的 EFS 相关,但与管腔 A 或 B 肿瘤无关。在意向治疗人群中,与单独使用曲妥珠单抗相比,双曲妥珠单抗加拉帕替尼阻断有 EFS 获益的趋势;然而,在 ERBB2 富集亚型中,曲妥珠单抗加拉帕替尼与单独使用曲妥珠单抗相比具有显著且独立的 EFS 益处(HR,0.47;95% CI,0.27-0.83;P = .009)。总体而言,618 个基因表达特征中有 275 个(44.5%)与 pCR 显著相关,618 个基因表达特征中有 9 个(1.5%)与 EFS 显著相关。ERBB2/HER2 扩增子和多种免疫特征与 pCR 显著相关。管腔相关特征与较低的 pCR 率但较好的 EFS 相关,尤其是在有残留疾病的患者中,并且与激素受体状态无关。pCR 的显著调整 HR 范围为 0.45 至 0.81(较高的 pCR)和 1.21-1.94(较低的 pCR 率);EFS 的显著调整 HR 范围为 0.71 至 0.94。
表皮生长因子受体 2- 的心脏毒性......
乳腺癌是女性最常见的癌症,发病率逐年上升。20% 至 25% 的侵袭性乳腺癌与人表皮生长因子受体 2(HER2 或 ErbB2)过表达有关,且预后不良。HER2 靶向治疗显著提高了 HER2 阳性乳腺癌患者的总体生存率。然而,尽管该疗法有诸多好处,但其心脏毒性却是一个主要问题,尤其是当 HER2 靶向治疗与蒽环类药物联合使用时。目前,这种心脏毒性的机制尚不完全清楚。目前认为,HER2 靶向药物抑制 HER2/NRG 1 二聚体的形成,导致心肌细胞线粒体中 ROS 增加,并抑制 PI3K/Akt 和 Ras/MAPK 通路,导致细胞凋亡。抗氧化剂、血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体阻滞剂、β受体阻滞剂、他汀类药物等与ErbB2靶向药物合用可能具有心脏保护作用。NT-proBNP可用于HER2靶向治疗期间曲妥珠单抗所致心脏毒性的监测,可作为临床预测心脏毒性的生物学标志物。NT-proBNP检测具有非侵入性、廉价、可重复性等特点,值得临床医生重视。本文旨在探讨ErbB2靶向药物心脏毒性的潜在机制、临床特点、诊断策略和干预策略。
胃食管癌患者的精准医疗:ProfiLER 程序的子集分析
结果 147 例患者中,腺癌 (n=86, 59%)、印戒细胞癌 (n=37, 25%) 和鳞状细胞癌 (n=21, 14%) 为主要组织学类型。114 例 (78%) 患者可进行基因组分析。最常见的基因组变异包括 ERBB2 (15%)、KRAS (12%)、CCND1 (7%)、FGFR1-3 (8%)、EGFR (5%) 和 MET (3%)、TP53 (51%) 和 CDKN2A/B (10%)。ERBB2、MET 和 FGFR 变异仅见于腺癌和印戒细胞亚型,而 CCND1 扩增、TP53 突变和 CDKN2A/B 缺失见于腺癌和鳞状细胞亚型。 9 名患者 (8%) 接受了与其基因组变异相匹配的治疗,其中 5 名患者实现了疾病控制。在一项探索性分析中,诊断时患有 IV 期疾病且具有可操作变异的患者与没有可操作变异的患者相比,总生存期更长。
胶质母细胞瘤患者放射治疗的个性化问题的生物学方面
谷氨酰胺是胶质母细胞瘤细胞的必要底物,对肿瘤生长很重要。我们研究了ERN1敲低对EGFR,ERBB2,TOB1和CEBPB基因表达在U87MG胶质母细胞瘤细胞中响应谷氨酰胺缺乏的影响。表明,EGFR和ERBB2基因的表达水平与对照胶质母细胞瘤细胞中的谷氨酰胺缺乏症相关,但ERN1敲低导致上调这些基因表达。此外,在对照和ERN1敲低胶质母细胞瘤细胞中,TOB1和CEBPB基因表达对谷氨酰胺剥夺敏感,但抑制ERN1会显着提高这些基因对谷氨酰胺剥夺的敏感性,尤其是CEBPB基因。这些结果表明,内质网应激的主要信号通路ERN1控制着所有研究的基因对基因特异性方式胶质母细胞瘤细胞中谷氨酰胺剥夺的敏感性,并且以基因特异性方式,并且较低路径。
HER2阳性胃癌患者的治疗策略
胃癌(GC)在全球范围内是一个主要的健康问题,在频率上排名第五,与癌症相关的死亡率排名第四。在中国,估计每年诊断出396,500例新病例,后期疾病占病例2的80%以上。由于诊断晚期和异性特征,GC的预后仍然很差。对于患有晚期疾病的患者,传统的化疗一直是治疗的主要手段,但其临床结果远非令人满意,5年的存活率低于10%。在过去的几十年中,有针对性的治疗和免疫疗法的进展取得了无与伦比的改善,精确肿瘤学方面的进步。对于GC,人类表皮生长因子受体2(HER2,也称为ERBB2)是药物干预措施的主要目标,并有望将来临床应用。ERBB2的扩增可以诱导HER2蛋白的过表达,并导致表皮生长因子受体(EGFR)成员的异二聚体ization,从而激活一系列信号通路并促进肿瘤发生。 曲妥珠单抗的成功导致了GC靶向疗法的新时代,并使Her2阳性亚组成为独特的疾病实体,占所有GC病例的15%–20%。 但是,遵循乳腺癌后的路径,ERBB2的扩增可以诱导HER2蛋白的过表达,并导致表皮生长因子受体(EGFR)成员的异二聚体ization,从而激活一系列信号通路并促进肿瘤发生。曲妥珠单抗的成功导致了GC靶向疗法的新时代,并使Her2阳性亚组成为独特的疾病实体,占所有GC病例的15%–20%。但是,遵循乳腺癌后的路径,
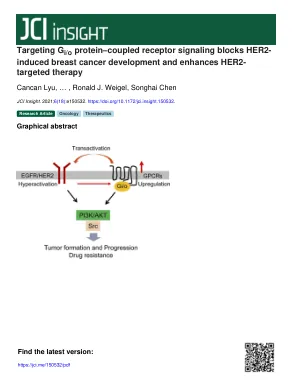
针对 G 蛋白偶联受体信号阻断 HER2...
简介乳腺癌是美国女性最常见的癌症,也是第二大癌症死亡原因。大约 15%–20% 的乳腺癌过度表达 ErbB2/HER2,因此被归类为 HER2 + 亚型,这种亚型与侵袭性癌症和不良临床结果有关 (1)。HER2 是 ErbB 家族的成员,该家族包括 EGFR/ErbB1、ErbB2/HER2、ErbB3 和 ErbB4 — 均为跨膜受体酪氨酸激酶(参考文献 2、3)。ErbB2/HER2 没有已知的配体,但可以与 EGFR 或 HER3 同源二聚化或异源二聚化 (4)。二聚化的 HER2 激活一系列复杂的下游信号级联,主要由 PI3K/AKT 和 MAPK 通路组成 (4)。HER2 过度活化会诱导乳腺肿瘤的形成、进展和转移。 HER2 + 乳腺癌最成功的治疗方法是 HER2 靶向治疗 (5)。FDA 批准的几种抗 HER2 药物,包括人源化单克隆抗体曲妥珠单抗和 HER2 和 EGFR 的小分子双重抑制剂拉帕替尼,显著改善了 HER2 + 乳腺癌患者的临床结果。然而,最初对 HER2 靶向治疗有反应的肿瘤最终可能会产生耐药性 (5)。为了改善晚期 HER2 + 乳腺癌的临床结果,开发新的治疗方法以提高 HER2 靶向治疗的疗效至关重要。GPCR 是最大的细胞表面受体家族;它们由 800 多个成员组成,可调节多种生物功能 (6)。GPCR 功能障碍会驱动许多肿瘤的发展和进展,包括乳腺癌 (7)。转录组分析显示乳腺癌细胞异常表达多种 GPCR (8)。在多种乳腺癌分子亚型中,蛋白质组学分析可识别异常的 GPCR 激活 (9)。
针对GI/O蛋白耦合受体信号传导阻止HER2
引言乳腺癌是美国女性最常见的癌症,也是癌症死亡的第二常见原因。大约15%–20%的所有乳腺癌过表达ERBB2/HER2,因此被分类为HER2 +亚型,这与临床结果较差的攻击性癌症有关(1)。HER2是ERBB家族的成员,其中包括EGFR/ERBB1,ERBB2/HER2,ERBB3和ERBB4 - 所有跨膜受体酪氨酸激酶(参考文献2,3)。erbb2/her2没有已知的配体,但可以与EGFR或HER3(4)均匀地二聚二聚体或异二聚体。二聚体HER2激活了一个复杂的下游信号级联,主要由PI3K/AKT和MAPK途径组成(4)。HER2过度激活诱导乳腺肿瘤的形成,进展和转移。 HER2 +乳腺癌最成功的治疗方法是Her2靶向治疗(5)。 几种FDA-批准的抗HER2药物,包括人源化的单克隆抗体,曲妥珠单抗和HER2和EGFR的小分子双抑制剂,Lapatinib,显着改善了HER2 +乳腺癌患者的临床结果。 然而,最初对HER2靶向疗法反应的肿瘤最终会产生抗药性(5)。 为了改善晚期HER2 +乳腺癌的临床结果,开发新型治疗方法以提高HER2靶向治疗的功效至关重要。 GPCR是最大的细胞表面受体家族。它们由800多个调节大量生物学功能的成员组成(6)。 GPCR功能障碍推动了包括乳腺癌在内的许多肿瘤的发育和进展(7)。HER2过度激活诱导乳腺肿瘤的形成,进展和转移。HER2 +乳腺癌最成功的治疗方法是Her2靶向治疗(5)。几种FDA-批准的抗HER2药物,包括人源化的单克隆抗体,曲妥珠单抗和HER2和EGFR的小分子双抑制剂,Lapatinib,显着改善了HER2 +乳腺癌患者的临床结果。然而,最初对HER2靶向疗法反应的肿瘤最终会产生抗药性(5)。为了改善晚期HER2 +乳腺癌的临床结果,开发新型治疗方法以提高HER2靶向治疗的功效至关重要。GPCR是最大的细胞表面受体家族。它们由800多个调节大量生物学功能的成员组成(6)。GPCR功能障碍推动了包括乳腺癌在内的许多肿瘤的发育和进展(7)。转录组分析表明,乳腺癌细胞异常表达多个GPCR(8)。在多种乳腺癌分子亚型中,蛋白质组学分析鉴定了异常的GPCR激活(9)。
突破 HER2+ 癌症的治疗障碍
尽管胃食管癌 (GEA) 的发病率在 50 年来有所下降,但它仍然是全球的主要健康负担。GEA 是癌症死亡的第三大原因,每年全球有超过 100 万人新诊断出患有 GEA,其中大多数已经转移,并且目前还没有可预见的有效筛查计划 ( Bray 等人,2018 年)。原癌基因 HER-2/neu ( erbb2 ) 在约 1/5 的 GEA 患者的肿瘤中过度表达和扩增 ( Bang 等人,2010 年)。HER2 是一种众所周知的致癌驱动基因,已被 ToGA 试验证实为乳腺癌和 GEA 的有效靶点,结果显示,与仅接受化疗的患者相比,接受化疗和抗 HER2 单克隆抗体曲妥珠单抗治疗的 HER2 阳性 (HER2+) 患者的生存获益明显 ( Bang 等人,2010 年)。然而,与乳腺癌相比,迄今为止,其他 HER2 靶向策略尚未改善 GEA 这种分子亚型的治疗结果。这些策略包括在曲妥珠单抗中添加第二种抗 HER2/3 单克隆抗体(帕妥珠单抗,JACOB 试验)或细胞毒性药物(曲妥珠单抗 emantansine,T-DM1,GATSBY 试验)或使用双重 HER1/HER2 酪氨酸激酶抑制剂代替曲妥珠单抗来关闭 HER2 信号传导(TYTAN 和 LOGiC 试验)(图 1 A)。在 GEA 中,经常发生对曲妥珠单抗的内在和获得性耐药,这是由于 ERBB2 扩增的病变内异质性、ERBB2 外显子 16 的缺失以及 KRAS 、 EGFR 、 MET 、 HER3 、 PI3K 或 PTEN 基因的共突变和/或扩增所致( Janji-gian 等人,2018 年; Sanchez-Vega 等人,2019 年; Volpi 等人,2019 年)。