XiaoMi-AI文件搜索系统
World File Search SystemSterilization
课程vitae
• Company needing new NB had to approach more than 15 NBs • Costs for conformity assessment have multiplied by 10× • One company reported paying $ 6,500 per day per reviewer • Identical sterilization process being reassessed for each device • > $ 700k already spent without one new certificate being issued • Certification costs for individual device equivalent to 4× annual sales • Notified body costs equivalent to 30 – 50 % of turnover • Only 13% of他们的产品留在市场上
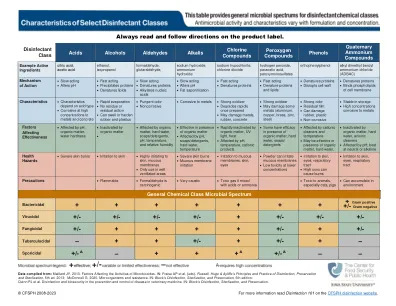
选定的消毒类的特征
来自:Maillard JY的数据。2013。影响微生物活性的因素。 in:Fraise AP等。 (eds)。 Russell,Hugo&Ayliffe的消毒,保存和灭菌的原则和实践,第5版。 2013; McDonnell G.2020。 微生物和抗性。 in:第6版的块消毒,灭菌和保存; Quinn PJ等。 在兽医中预防和控制疾病的消毒和生物安全性。 in:块的消毒,灭菌和保存。影响微生物活性的因素。in:Fraise AP等。(eds)。Russell,Hugo&Ayliffe的消毒,保存和灭菌的原则和实践,第5版。2013; McDonnell G.2020。微生物和抗性。in:第6版的块消毒,灭菌和保存; Quinn PJ等。在兽医中预防和控制疾病的消毒和生物安全性。in:块的消毒,灭菌和保存。
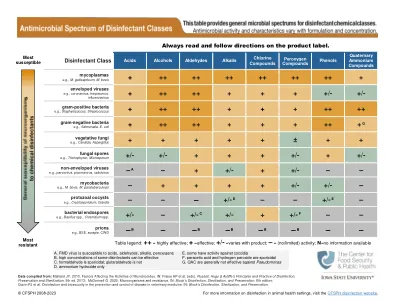
消毒剂的抗菌光谱
来自:Maillard JY的数据。2013。影响微生物活性的因素。 in:Fraise AP等。 (eds)。 Russell,Hugo&Ayliffe的消毒,保存和灭菌的原则和实践,第5版。 2013; McDonnell G.2020。 微生物和抗性。 in:第6版的块消毒,灭菌和保存; Quinn PJ等。 在兽医中预防和控制疾病的消毒和生物安全性。 in:块的消毒,灭菌和保存。影响微生物活性的因素。in:Fraise AP等。(eds)。Russell,Hugo&Ayliffe的消毒,保存和灭菌的原则和实践,第5版。2013; McDonnell G.2020。微生物和抗性。in:第6版的块消毒,灭菌和保存; Quinn PJ等。在兽医中预防和控制疾病的消毒和生物安全性。in:块的消毒,灭菌和保存。
热科学二氧化碳孵化器与140°C干热...
结果和讨论微生物测试的完整和截短的140°C灭菌周期的微生物测试结果如表1所示。在每种情况下,在140°C的干热周期中的任何一个中,来自不锈钢载体的任何样品中均未发现生长,证明了全部消除。在不同日期,所有截短的运行均显示结果的一致性,增长为零。阴性对照没有显示生长(未显示结果),表明技术人员没有样品污染。阳性对照与测试样品相同,除了未放入孵化器中。由于所有灭菌周期都能够消除所有微生物,包括用于干热量灭菌的规定生物学指标孢子,因此恢复程序仅用于阳性对照。表2中为323 L模型提供的结果清楚地表明,恢复的所有正面对照至少为10 6 CFU/载体,因此成功满足了所有接受标准。表3中给出的232升模型中所示的结果表明,最重要的生物学指标(抗抗热孢子孢子芽孢杆菌)最少回收了10 6 CFU/载体。这些结果证明,140°C的灭菌程序至少达到6-7 log 10减少抗脂肪芽孢杆菌的抗热孢子,符合EUP和USP的干热量灭菌所需的灭菌标准。
CleanSpace-HALO-STERRAD-再处理。......
最好将电源装置和组件放在托盘中以便进行再处理。下面显示了一个示例。按照 STERRAD 灭菌系统制造商的说明,在灭菌之前包装组件。不建议使用袋子,但可以使用包装进行再处理。下面显示了一个包装示例。
8000 系列直热式和水套式 CO2 培养箱
直接加热灭菌循环 – 140°C 下 120 分钟 – 确保消除每个培养箱表面的所有微生物和真菌孢子 (ANSI/AAMI/ISO 11134)。此声明已通过针对干热过程校准的枯草芽孢杆菌孢子悬浮液得到验证,因为这些孢子对干热灭菌具有最强的抵抗力,因此是推荐的指示生物(美国药典,第 1035 章)。在 140°C 下 120 分钟的灭菌循环后,施加到培养箱不同表面的所有孢子 – 腔壁(不锈钢)、门(玻璃)和门垫圈(钢化硅胶)都已可靠地消除。
亚利桑那技术委员会信托PPO 6000 70计划
$0 for professional charges for implantation and/or removal (including follow-up care) of FDA-approved female implanted contraceptive (birth control) devices when the purpose of the procedure is contraception, as documented by your provider on the claim $0 for professional and facility charges for FDA-approved female sterilization procedures when the purpose of the procedure is contraception, as documented by your provider on the claim $0 for female口服避孕药,贴剂,环和避孕注射剂0美元用于FDA批准的非处方紧急避孕避孕药,由医生或其他医疗保健提供者处方$ 0,用于diaphragms,宫颈帽,宫颈帽,宫颈屏蔽,避孕套,海绵,海绵和骨架的男性固化性手术:
Thermo Scientific 8000 系列 – 直接加热和水套...
直接加热灭菌循环 – 140°C 下 120 分钟 – 确保消除每个培养箱表面的所有微生物和真菌孢子 (ANSI/AAMI/ISO 11134)。此声明已通过针对干热过程校准的枯草芽孢杆菌孢子悬浮液得到验证,因为这些孢子对干热灭菌的抵抗力最强,因此是推荐的指示生物 (美国药典,ch.1035)。施加到培养箱不同表面的所有孢子 – 腔壁 (不锈钢)、门 (玻璃) 和门垫圈 (钢化硅胶),在 140°C 下 120 分钟的灭菌循环后已被可靠地消除。
CFP系列PES膜
性能工作条件最大工作温度80°C最大。工作压差 4 bar @ 21 °C , 2.4 bar @ 80 °C - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - 灭菌 高压灭菌器灭菌 121°C , 60 分钟 SIP 135°C , 30 分钟 , 20 个循环 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - 过滤面积 Ø 69mm 0.65 m² / 10” 滤芯 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - 可萃取物 10” 滤芯 ﹤ 20 毫克
术中应用和早期经验,具有新型的高分辨率,高通道计数薄膜电极的
结果 - 分析中包括89例患者,这些患者接受了切除肿瘤(n = 58)或癫痫组织(n = 31)的患者。这些案件占94个网格; 58 PEDOT:PSS网格和36个PTNRGRIDS。有86个功能性,并成功用于从82例患者那里获得皮质记录。平均皮质网格记录持续时间为15.3±1.15分钟。在实验任务(n = 52,58.4%)中获得了大多数患者的记录,涉及语言和感觉运动测试范例,或在静止状态下被动地获得(n = 32,38.1%)。没有与网格放置有关的术中不良事件。然而,有一些与术前绝育(n = 7)和不当处理(n = 1)造成的PTNRGRID功能障碍(n = 8)有关的损害;没有进行术中记录。蒸发过氧化物(V-PRO)灭菌是PTNRGRIDS最佳的灭菌方法,与基于蒸汽的灭菌技术相比,可用通道的数量明显高得多(905.0 [650.8-935.5] vs. 356.0 vs.356.0 [18.0-0-597.8.8],p = 0.0031,p = 0.0031。