XiaoMi-AI文件搜索系统
World File Search System多药物和在住院的Covid-19患者中靶向的潜在体蛋白的硅预测
所有患者通过PCR测试对Covid-19的阳性呈阳性,他们显示出疾病的不同体征和症状。所有患者均未康复,所有患者都去世了。所有33名患者都接受了许多治疗剂,在住院期间,患者的数量从八个到20名。平均药物数量为15±3。我们确定了2/33(6%)主要多药(8和9)和31/33(94%)的患者,多药(15.5±2.7)。多药物中确定的药物总数为37,不包括维生素,矿物质和静脉溶液。施用的药物频率如下:抗生素(67,13.7%),粘液溶剂剂(56,11.5%),皮质类固醇(54,11%),抗凝剂(48,9.8%),抗病毒剂,抗病毒剂(41,8.4%),抗生素(41,8.4%),抗生素(4.4%)(3.5%)(282),32,32,32,32,32,32,32,32,3.5%,,,抗病毒,,抗病毒作用(32),,抗病毒剂,,抗病毒剂,,抗病毒剂(3.4%),抗病毒剂(41%),抗病毒剂(41%)。抗真菌药物(27,5.5%),抗糖尿病药(26,5.3%)和其他药物(2-19,0.41-3.9%)。使用SwisStargetPrediction计划,发现各种药物,包括参与多药剂的抗病毒剂,以硅体蛋白的靶向为目标,预测百分比为6.7%至40%。
弹性蛋白靶向纳米粒子递送强力霉素可缓解细胞因子风暴并减少 LPS 介导的肺部炎症中的免疫细胞浸润
气道重塑是急性和慢性肺部疾病(如急性病毒感染,包括 SARS-CoV-2 和肺气肿)最明显的后果,它是呼吸系统结构成分中促炎性细胞内和细胞外事件的后遗症 [1,2]。这些气道疾病导致上皮细胞凋亡和炎性细胞浸润。所有这些病理事件均导致或由肺泡弹性蛋白损伤所致,而肺泡弹性蛋白是呼吸力学的重要组成部分,负责肺弹性回缩。促炎性细胞因子 IL-6、IL-1 β、TNF- α、IL-23 和蛋白酶 MMPs 2、9 和 12 是肺部炎症相关变化的常见调控因子 [3]。它们已被证实可以降低弹性蛋白 mRNA 表达或直接降解肺中的弹性蛋白。这些细胞因子目前不仅是 COPD 药物研发的主要靶点,也是肺部病毒感染引起急性肺损伤的主要靶点。FDA 已批准两类 IL-6 抑制剂用于治疗 COVID 19,即 a) 抗 IL-6 受体单克隆抗体 (mAb)(例如 sarilumab、tocilizumab)和 b) 抗 IL-6 mAb(即 siltuximab)。FDA 最近于 2022 年 12 月 21 日批准托珠单抗与地塞米松一起用于 COVID 19 患者作为辅助疗法,而 Sarilumab 尚未被批准用于细胞因子风暴管理 [4]。然而,这些药物有严重的副作用,包括中性粒细胞减少症、低纤维蛋白原血症和增加继发感染的风险,如结核病、细菌和真菌感染以及碗穿孔,限制了它们在一般健康人群中的使用 [5]。强力霉素 (Doxy) 已被发现在许多情况下是一种有用的药物。最近的一份报告显示,用 Doxy 治疗 Vero E6 细胞前后均能以剂量依赖性方式有效抑制 SARS-CoV-2 毒株 (IHUMI-3) [6]。Doxy 的抗炎潜力被用于治疗慢性疾病,包括布鲁氏菌病性脊柱炎、创伤性脑损伤、腹主动脉瘤,其中它已被证明可以降低全身炎症标志物 IL-6 的水平,并抑制 MCP-1 和 MMP 等趋化因子 [7-10]。相反,Butler 等人最近的一项研究表明,用强力霉素(口服)治疗并不能减少 COVID-19 相关的康复时间以及死亡人数 [11]。然而,这是系统性地给予一种首过代谢损失很大的药物,因此可能无法在局部肺组织中达到高浓度。此前,我们已经证明单次静脉注射注射弹性蛋白抗体偶联的载有强力霉素的牛血清白蛋白纳米颗粒 (Doxy NP) 可有效靶向肺气肿,并导致强力霉素在四周内局部持续释放到肺部,与强力霉素 IV 相比,导致基质金属蛋白酶 (MMP) 活性降低 [ 12 ]。我们的方法是当纳米颗粒进入肺部弹性蛋白损伤部位时将强力霉素输送到肺部,因此,少量药物比全身剂量更有效。我们并不是说这种疗法可以恢复 COVID 患者的肺部,而是强调靶向给药比全身给药更好。 Doxy 的作用部分在于抑制蛋白激酶 B (AKT) 信号通路和丝裂原活化蛋白激酶 (MAPKs) 信号蛋白,包括体外 VSMC 中的细胞外信号调节激酶 (ERK)、c-Jun 氨基末端激酶 (JNK) [ 5 ]。其炎症小体抑制能力被发现有利于改变前列腺癌 (PC3) 和肺癌细胞系 (A549) 中的肿瘤微环境 [ 13 ]。然而,目前尚不清楚 Doxy 如何抑制炎症反应,特别是在肺部。我们想测试 Flexibzumab 偶联的载有强力霉素的牛血清白蛋白纳米颗粒的静脉输送是否
deltarex-g,针对CCNG1抑制剂的肿瘤靶向逆转录子,用于CAR-T细胞疗法诱导细胞因子释放综合征
细胞因子释放综合征是嵌合抗原受体-T细胞疗法的严重并发症,并且是通过嵌合T细胞过度分泌炎性细胞因子而触发的,这可能是致命的。在调查了整理细胞因子释放综合征的分子机制之后,我们假设Deltarex-G是一种靶向肿瘤的逆转录子编码胞质CCNG1抑制剂基因的肿瘤,可能是皮质类固醇耐药的细胞因子释放综合征的可行治疗方法。Deltarex-G获得了美国食品和药物管理局紧急使用授权,以治疗COVID-19引起的急性呼吸窘迫综合征,这是由于过度活化的免疫细胞。短暂的deltarex-G给药会抑制一定比例的多动性嵌合T细胞,从而减少细胞因子释放,同时保持嵌合T细胞效率。
心脏氧化应激,炎症细胞因子反应,心脏泵功能和预后肌梗死后的关系
这项研究深入研究了心肌梗塞后个体的心脏氧化应激,炎性细胞因子反应,心脏泵功能和预后之间的潜在联系。基于药物干预策略,总共将276名患者分为两组:对照组(n = 130)和观察组(n = 146)。对照组接受了标准药物治疗,而观察组除了标准治疗外,还接受了针对抗氧化剂和抗炎治疗的早期药物干预。血清炎性因子的水平,包括肿瘤坏死因子-α(TNF-α),白介素1β(IL-1β)和白介素9(IL-6)。使用叉子盒蛋白A2(FOX2)试剂来确定总体氧化水平。使用多普勒超声测量左心室末端直径(LVEDD),左心室射血分数(LVEF)和端 - 收缩期直径(ESD)。与对照组相比,观察组的血清TNF-α,IL-1β和IL-6的血清水平显着降低(P <0.05)。此外,与对照组相比,观察组的总氧化水平较低,OSI,EDD和ESD(P <0.05),而观察组的LVEF和TAS水平高于对照组中的LVEF和TAS水平(P <0.05)。非常明显,与对照组相比,观察组的重新性,心力衰竭,心律失常和异常瓣膜功能的发生率显着降低(p <0.05)。心脏泵功能的降低和更不利的预后与心脏氧化应激和炎症因子水平升高有关(p <0.05)。适当的药物及时干预对降低炎症标记水平,降低氧化压力以及增强心脏泵送能力和整体预后至关重要。
肝选择性葡萄糖激酶激活剂TTP399对1型糖尿病患者胰岛素戒断期间酮症酸中毒的影响
孕产妇感染已成为神经发育障碍(包括精神分裂症和自闭症谱系)的重要环境风险因素。母体免疫激活(MIA)的动物模型系统表明,母体免疫反应在后代的神经发育和行为结果中起着重要作用。细胞外的自由水是大脑中自由扩散水的量度,可能与神经蛋白浮动有关并受到MIA的影响。本研究评估了雄性恒河猴(Macaca mulatta)的脑扩散特征(Macaca Mulatta),其暴露于MIA的大坝(n = 14),并用病毒模拟聚细胞毒素的改良形式治疗,在三个三等中心的结束时。控制大坝在孕早期结束时接受了盐水注射(n = 10)或未经处理(n = 4)。后代在6、12、24、36和45个月进行了扩散MRI扫描。阳性大坝出生的后代表明,在6个月大时才开始,在扣带回皮层灰质中明显增加了细胞外的无细胞外水,并一直持续到45个月。此外,该地区的后代无灰物质无水与暴露于MIA的大坝中母体IL-6反应的大小显着相关。在暴露于MIA的后代中大脑体积与细胞外水之间的显着相关性也表明,MIA对脑发育的影响的融合,多模式的证据。在暴露于子宫内受到免疫激活的个体中,升高的自由水可能代表了扰动或脆弱的神经发育轨迹的早期标记。这些发现为非人类灵长类动物MIA模型的构建有效性提供了有力的证据,作为研究人类神经发育精神疾病的病理生理学的相关系统。
体外诱导辅助人的训练有素的免疫力...
6。第7天或更高版本:ELISA评估细胞因子水平。按照制造商的说明执行ELISA。上清液中细胞因子的浓度通常高于商业试剂盒的检测极限,因此需要在制造商指定的稀释缓冲液中稀释样品。对于R&D Duoset Elisa试剂盒,从单核细胞中稀释的稀释剂培训了用B -glucan或bcg训练并在第6天用LPS添加的稀释剂为10 3 –20 3 TNF A和25 3 –100 3 - 100 3稀释3 –100 3以检测IL -6。每个刺激需要优化稀释液,并且在实验室,批次刺激和供体之间可能有所不同。The appropriate controls for the assay are the following: - Non-trained, non-rechallenged cells: No detectable cytokine production - Trained, non-rechallenged cells: No detectable cytokine production - Non-trained, rechallenged cells: High cytokine production - Trained, rechallenged cells: Very high cytokine production
在重复SARS-COV-2 BNT162B2 mRNA疫苗接种后,与适应性免疫相关的快速瞬时和持久的先天因子变化
细胞因子和趋化因子在响应感染和疫苗接种时塑造先天和适应性免疫方面起着重要作用。解剖早期先天疫苗的特征可能可以预测免疫原性,以帮助优化mRNA和其他疫苗策略的效率。在黄热病,HIV-DADE5,HIV ALVAC,EBOLA RVSV-ZEBOV和三价插入(TIV)疫苗接种(1-7)之后(1-7),几项研究早在黄热病,HIV-ADE5,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,,进行了一些研究(Div>)。 了解COVID-19-BNT162B2 mRNA的影响(P-Files/Biontech)(8)疫苗对先天和训练的免疫反应[(9)中的综述]具有极大的兴趣,并有助于调节适应性免疫。 我们和其他人使用系统血清学(10,11),多膜方法和基于流量的测定法(12-14)的BNT162B2 mRNA疫苗接种后的早期作用(12-14)。 系统的血清学鉴定的免疫学参数可预测COVID-19 Incotection-Ne自愿者中BNT162B2 mRNA疫苗的有益反应(10),COVID-19,康复患者(10)和患有血液学恶性肿瘤的跨性别患者(11)。 我们确定了一个系统性签名,可在1 st 之后24小时检测到几项研究早在黄热病,HIV-ADE5,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,HIV-ALVAC,,进行了一些研究(Div>)。了解COVID-19-BNT162B2 mRNA的影响(P-Files/Biontech)(8)疫苗对先天和训练的免疫反应[(9)中的综述]具有极大的兴趣,并有助于调节适应性免疫。我们和其他人使用系统血清学(10,11),多膜方法和基于流量的测定法(12-14)的BNT162B2 mRNA疫苗接种后的早期作用(12-14)。系统的血清学鉴定的免疫学参数可预测COVID-19 Incotection-Ne自愿者中BNT162B2 mRNA疫苗的有益反应(10),COVID-19,康复患者(10)和患有血液学恶性肿瘤的跨性别患者(11)。我们确定了一个系统性签名,可在1 st
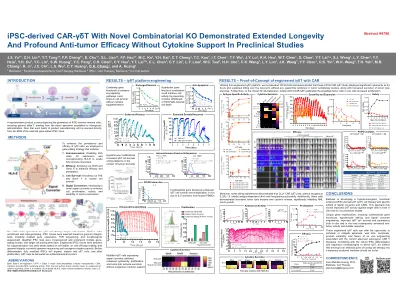
具有新型组合 KO 的 iPSC 衍生 CAR-γδT 在临床前试验中无需细胞因子支持即可表现出更长的寿命和显著的抗肿瘤功效
用于 iγδT 细胞疗法的 GMP 克隆生成始于人类 PBMC。在富集和重编程后,根据基因组完整性测试(包括残留基因表达、TCR 测序和形态学评估)选择 iPSC 克隆。合格的 iPSC 系被冷冻保存并经过多轮基因编辑,每轮之后进行单细胞分选。根据细胞健康、靶向和脱靶编辑以及基因组完整性(通过全基因组测序和致癌基因突变面板)选择工程 iPSC 克隆进行冷冻保存到种子库中。在分化之前,完全改造的 iPSC 将扩增、成熟为 γδT 细胞,增殖后,iγδT 细胞被收获为药品。
用免疫检查点抑制剂治疗后的细胞因子释放综合征:瑞典Karolinska大学医院的2672名患者的观察队列研究
1。Bagchi,S.,R。Yuan和E.G. Engleman,治疗270癌症的免疫检查点抑制剂:临床影响和反应和抗性机制。 Annu Rev Pathol,2021。 271 16:p。 223-249。 272 2。 yin,Q。等,免疫相关的免疫检查点抑制剂的不良事件:综述。 273前免疫,2023。 14:p。 1167975。 274 3。 Haanen,J。等人,免疫疗法的毒性管理:ESMO临床实践275诊断,治疗和随访指南。 Ann Oncol,2022。 33(12):p。 1217-1238。 276 4。 Naidoo,J。等人,癌症免疫疗法学会(SITC)共识定义277个免疫检查点抑制剂相关的免疫相关的不良事件(IRAES)术语。 J 278免疫癌症,2023年。 11(3)。 279 5。 Martins,F。等,免疫检查抑制剂的不良影响:流行病学,280管理和监视。 nat Rev Clin Oncol,2019年。 16(9):p。 563-580。 281 6。 Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。 J免疫283癌症,2023年。 11(3)。 284 7。 Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。 生物血骨髓移植,2019年。 25(4):p。 E123-E127。 286 8。 Ann Oncol,2021。 32(1):p。 34-48。 288 9。Bagchi,S.,R。Yuan和E.G.Engleman,治疗270癌症的免疫检查点抑制剂:临床影响和反应和抗性机制。Annu Rev Pathol,2021。271 16:p。 223-249。272 2。yin,Q。等,免疫相关的免疫检查点抑制剂的不良事件:综述。273前免疫,2023。14:p。 1167975。274 3。Haanen,J。等人,免疫疗法的毒性管理:ESMO临床实践275诊断,治疗和随访指南。 Ann Oncol,2022。 33(12):p。 1217-1238。 276 4。 Naidoo,J。等人,癌症免疫疗法学会(SITC)共识定义277个免疫检查点抑制剂相关的免疫相关的不良事件(IRAES)术语。 J 278免疫癌症,2023年。 11(3)。 279 5。 Martins,F。等,免疫检查抑制剂的不良影响:流行病学,280管理和监视。 nat Rev Clin Oncol,2019年。 16(9):p。 563-580。 281 6。 Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。 J免疫283癌症,2023年。 11(3)。 284 7。 Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。 生物血骨髓移植,2019年。 25(4):p。 E123-E127。 286 8。 Ann Oncol,2021。 32(1):p。 34-48。 288 9。Haanen,J。等人,免疫疗法的毒性管理:ESMO临床实践275诊断,治疗和随访指南。Ann Oncol,2022。33(12):p。 1217-1238。276 4。Naidoo,J。等人,癌症免疫疗法学会(SITC)共识定义277个免疫检查点抑制剂相关的免疫相关的不良事件(IRAES)术语。J 278免疫癌症,2023年。11(3)。279 5。Martins,F。等,免疫检查抑制剂的不良影响:流行病学,280管理和监视。 nat Rev Clin Oncol,2019年。 16(9):p。 563-580。 281 6。 Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。 J免疫283癌症,2023年。 11(3)。 284 7。 Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。 生物血骨髓移植,2019年。 25(4):p。 E123-E127。 286 8。 Ann Oncol,2021。 32(1):p。 34-48。 288 9。Martins,F。等,免疫检查抑制剂的不良影响:流行病学,280管理和监视。nat Rev Clin Oncol,2019年。16(9):p。 563-580。281 6。Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。 J免疫283癌症,2023年。 11(3)。 284 7。 Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。 生物血骨髓移植,2019年。 25(4):p。 E123-E127。 286 8。 Ann Oncol,2021。 32(1):p。 34-48。 288 9。Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。J免疫283癌症,2023年。11(3)。284 7。Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。生物血骨髓移植,2019年。25(4):p。 E123-E127。286 8。Ann Oncol,2021。32(1):p。 34-48。288 9。Schubert,M.L。等,嵌合抗原受体(CAR)T-Cell 287治疗的副作用管理。Yomota,M。等,免疫检查点抑制剂289治疗非小细胞肺癌的细胞因子释放综合征。实习医学,2021年。60(21):p。 3459-3462。290
头颈部鳞状细胞癌患者接受 nivolumab 治疗后发生迟发性复发性细胞因子释放综合征:病例报告
纳武单抗是一种抗程序性死亡-1 (PD-1) 受体单克隆抗体,已被证明可有效治疗铂类耐药性转移性头颈部鳞状细胞癌。免疫相关不良事件 (irAE) 是 PD-1 抑制剂众所周知的并发症。同时,细胞因子释放综合征 (CRS),一种危及生命的免疫相关不良事件,很少因纳武单抗单药治疗而发生。在这里,我们报告了一例 65 岁男性的病例,他患有隐匿性原发性头颈部鳞状细胞癌,并出现了纳武单抗相关的晚发型 CRS 复发。患者入院时出现疲劳、发烧、低血压和呼吸窘迫的症状。血清白细胞介素 6 和铁蛋白水平升高支持 CRS 的诊断,患者对大剂量甲基泼尼松龙反应良好。CRS 在类固醇减量期间复发,同时肿瘤负担增加;然而,通过增加类固醇剂量可以成功控制。早期发现和使用类固醇治疗对于 CRS 的管理至关重要。