XiaoMi-AI文件搜索系统
World File Search Systeminfliximab
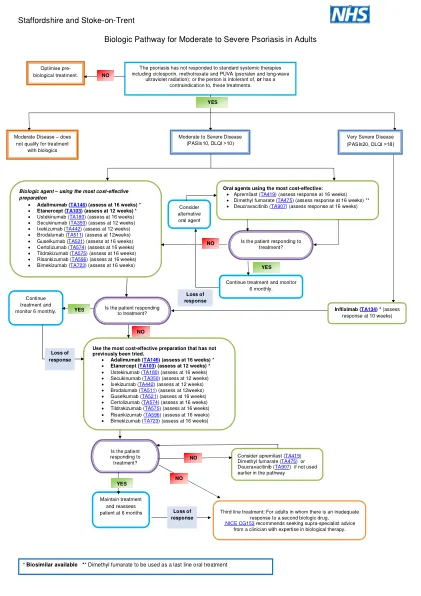
Staffordshire和Trent-on-Trent生物学途径...
decravacitinib tyk2抑制剂SPC:有用的口服毒剂可能会增加感染的风险,避免使用结核病的风险,避免使用恶性肿瘤的病史,包括淋巴瘤和非甲状腺瘤癌症患者在内的淋巴瘤和非甲状腺瘤的患者,避免使用过的患者,以避免使用过针刺的患者:淋巴细胞计数。Etanercept TNF-alpha inhibitor* SPC : Least effective biologic in psoriasis, for patients when infection risk is a significant concern, shorter half-life – more rapid washout if side effects of concern, avoid if risk of tuberculosis, heart failure, MS or demyelinating disorders Guselkumab IL23 inhibitor SPC : Avoid if risk of tuberculosis.英夫利昔单抗TNF-Alpha抑制剂* SPC:保留用于非常严重的牛皮癣或其他生物制剂的无反应者,避免是否患有结核病的风险,心力衰竭,MS或脱髓质疾病的风险,牛皮癣/牛皮癣的治疗选择,
轴向脊椎关节炎剂(PDF)
所有当前和将来的剂量表格都将需要 m aual g uidelines。 下表1中定义了所有药物特异性标准,包括每种药物的药物特异性指示,年龄和十二个。 abatacet(Orencia®Adamummb(Humira®T,Amjevita™,Cyltezo®,Haslimoz,Hyrimoz®,Dacio®,Dacio®,Simlandi®,Yunet®th(Olumian®)(Olumian®)Certolizumab(Cimzia®Etanercept(cimzia®Etanercept) (Remicade®,Avsola®,Inffecttra®,Renflexan(Rituxis®)Ruxience®,Truxim®)Sarimpion(Kevzara®Tocilizumab(Actemra®,Tofidence™,Tyenne®)Tofacitinib(Xeljanz®,Xeljanz®,Xeljanz Xr)m aual g uidelines。下表1中定义了所有药物特异性标准,包括每种药物的药物特异性指示,年龄和十二个。abatacet(Orencia®Adamummb(Humira®T,Amjevita™,Cyltezo®,Haslimoz,Hyrimoz®,Dacio®,Dacio®,Simlandi®,Yunet®th(Olumian®)(Olumian®)Certolizumab(Cimzia®Etanercept(cimzia®Etanercept) (Remicade®,Avsola®,Inffecttra®,Renflexan(Rituxis®)Ruxience®,Truxim®)Sarimpion(Kevzara®Tocilizumab(Actemra®,Tofidence™,Tyenne®)Tofacitinib(Xeljanz®,Xeljanz®,Xeljanz Xr)
在 SARS-CoV-2 大流行的 Omicron 浪潮期间,接受英夫利昔单抗治疗的 IBD 患者出现疫苗逃逸、突破和再感染增加
摘要 目的 抗肿瘤坏死因子 (TNF) 药物会削弱接种 SARS-CoV-2 疫苗后的血清学反应。我们试图评估第三剂信使 RNA (mRNA) 疫苗是否能显著增强接受英夫利昔单抗治疗的 IBD 患者的抗 SARS-CoV-2 抗体反应和保护性免疫。设计 在生物疗法对 SARS-CoV-2 感染和免疫的影响 (CLARITY) IBD 研究中,比较了接受英夫利昔单抗治疗的 IBD 患者中第三剂疫苗诱导的抗 SARS-CoV-2 刺突 (抗 S) 受体结合域 (RBD) 抗体反应、突破性 SARS-CoV-2 感染、再感染和持续性口咽携带者与接受维多珠单抗治疗的参考队列。结果 接种第三剂 mRNA 疫苗后,两组的抗 S RBD 抗体浓度几何平均数 (SD) 均增加。然而,无论前两剂基础疫苗是 ChAdOx1 nCoV-19(1856 U/mL (5.2) vs 10 728 U/mL (3.1), p<0.0001)还是 BNT162b2 疫苗(2164 U/mL (4.1) vs 15 116 U/mL (3.4), p<0.0001),接受英夫利昔单抗治疗的患者的抗体浓度均低于接受维多珠单抗治疗的患者的抗体浓度。然而,无论接受何种基础疫苗组合,在第三剂和第四剂 mRNA 疫苗接种后,抗 S RBD 抗体浓度均无差异。接种第三剂疫苗后,接受英夫利昔单抗治疗的患者的抗 S RBD 抗体半衰期估计值短于接受维多珠单抗治疗的患者(37.0 天(95% CI 35.6 至 38.6)vs 52.0 天(95% CI 49.0 至 55.4),p<0.0001)。与接受维多珠单抗治疗的患者相比,接受英夫利昔单抗治疗的患者更有可能出现 SARS-CoV-2 突破性感染(HR 2.23(95% CI 1.46 至 3.38),p=0.00018)和再感染(HR 2.10(95% CI 1.31 至 3.35),p=0.0019),但这种影响与第三剂疫苗抗 S RBD 抗体浓度无关。再感染主要发生在 Omicron 浪潮期间,并由 SARS-CoV-2
Pharmacy Solution 的生物仿制药趋势报告 - Aon
图表显示不同生物仿制药的采用率差异。生物仿制药包括贝伐单抗(Avastin®,用于治疗癌症);促红细胞生成素α(Epogen®,用于治疗贫血);非格司亭(Neupogen®,用于治疗白细胞计数偏低);英夫利昔单抗(Remicade®,一种免疫抑制剂);培非格司亭(Neulasta®,用于治疗白细胞计数偏低);利妥昔单抗(Rituxan®,多种用途,包括治疗癌症);和曲妥珠单抗(Herceptin®,用于治疗癌症)。随着医疗系统支付方对报销生物仿制药的态度发生变化,2019 年至 2022 年期间生物仿制药的采用率大幅增加。直到 2023 年,市场上大多数生物仿制药都是由医疗保健提供者管理并作为医疗福利计费的输注产品。这些药物的采用受提供者报销推动,因为提供者受到激励选择成本较低的替代方案。在医疗福利方面,各种因素相互协调,正如肿瘤学/免疫疗法类别的药物所表明的那样,生物仿制药已获得 80% 以上的市场份额。IQVIA 估计,从 2019 年到 2022 年,医疗福利节省 370 亿美元,这主要归功于生物仿制药。4
Janssen的无品牌生物学选择
选择了重要的安全信息严重,有时用Remicade®和英夫利昔单抗报告了致命的副作用。由于细菌,分枝杆菌,侵入性真菌,病毒或其他机会病原体(例如,TB,组织胞质病)引起的感染。淋巴瘤,包括致命的肝肾上腺素T细胞淋巴瘤(HSTCL)和其他恶性肿瘤病例,包括儿童和年轻患者。由于患有HSTCL的风险,主要是在克罗恩病和溃疡性结肠炎中报告的,因此评估了风险/益处,尤其是当患者是男性并且接受硫唑嘌呤或6-尾托嘌呤治疗时。Remicade®和英夫利昔单抗以中度或重度心力衰竭的患者以及对Remicade®和英夫利昔单抗的严重超敏反应的患者禁忌剂量> 5 mg/kg。报道的其他严重副作用包括黑色素瘤,默克尔细胞癌,浸润性宫颈癌,乙型肝炎的重生,肝毒性,血液学事件,超敏反应,心血管和脑血管反应期间和脑血管反应,输注事件,神经学事件,神经事件,以及诸如氏氏综合症。有关Remicade®和英夫利昔单抗,请参阅第12-15页的相关和其他重要安全信息。
鞘氨醇-1磷酸受体调节剂
溃疡性结肠炎 (UC) 和克罗恩病 (CD) 是影响胃肠道的慢性炎症性疾病,通常需要终生治疗。从历史上看,这些诊断的预后不佳,但人们对疾病过程的理解以及治疗方法都有了显着的改善。虽然仍然没有治愈性疗法,但药物治疗的主要内容是使用免疫抑制和免疫调节来诱导缓解和改善生活质量。1990 年代后期抗肿瘤坏死因子 (TNF) 疗法的引入彻底改变了药物治疗领域。在英夫利昔单抗首次获批后,多种静脉和皮下生物制剂加入了医疗设备库。 1-3 2021 年 5 月,奥扎尼莫德 (Zeposia,百时美施贵宝) 成为美国食品药品监督管理局 (FDA) 批准的首个用于治疗中度至重度活动性 UC 的鞘氨醇-1 磷酸 (S1P) 受体调节剂。4 本文讨论了 S1P 受体调节疗法的作用机制、疗效和安全性,并考虑了它们在治疗 UC 患者中的适当定位。
COVID-19 疫苗接种常见问题解答
o 阿达木单抗、赛妥珠单抗、依那西普、戈利木单抗、英夫利昔单抗、 o 沙利木单抗、托珠单抗 o 阿巴西普 o 阿普斯特 o 伊克珠单抗、苏金单抗 o 乌司他单抗 o 阿那白滞素 o 贝利木单抗 o 利妥昔单抗 JAK 抑制剂:巴拉替尼、托法替尼、乌帕替尼、非戈替尼 由于该疫苗不是活疫苗,因此如果您正在服用上述药物,则可以接种该疫苗。服用这些药物时,您对疫苗的反应可能会减弱。因此,您应该继续遵循政府关于降低感染风险的指导。最近接种过利妥昔单抗(也称为 Truxima、Rixathon、MabThera)的人可能不太可能对 COVID-19 疫苗产生免疫反应。这意味着,如果您在接种疫苗前 6 个月或接种疫苗后 4 周内使用过利妥昔单抗,疫苗的效果可能会降低。但是,如果您最近使用过利妥昔单抗,接种疫苗仍然是安全的,并且可能会从中受益。对于接受利妥昔单抗的风湿病患者,我们建议在前 2 剂疫苗接种时注意以下事项:
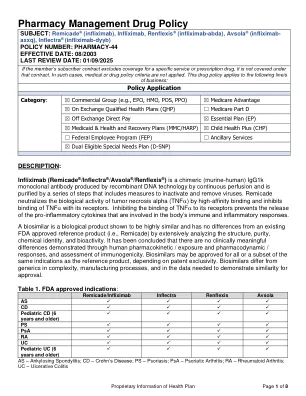
药房管理药品政策
描述:英夫利昔单抗(Remicade ® /Inflectra ® /Avsola ® /Renflexis ®)是一种嵌合(鼠-人)IgG1k 单克隆抗体,采用重组 DNA 技术通过连续灌注产生,并通过一系列步骤进行纯化,包括灭活和去除病毒的措施。Remicade 通过高亲和力结合中和肿瘤坏死因子 α(TNF )的生物活性,并抑制 TNF 与其受体的结合。抑制 TNF 与其受体的结合可阻止参与人体免疫和炎症反应的促炎细胞因子的释放。生物仿制药是一种生物产品,通过广泛分析结构、纯度、化学特性和生物活性,证明其与现有 FDA 批准的参考产品(即 Remicade)高度相似且没有差异。结论是,通过人体药代动力学/暴露和药效学/反应以及免疫原性评估,没有临床上有意义的差异。生物仿制药可能被批准用于与参考产品相同的全部或部分适应症,具体取决于专利独占性。生物仿制药在复杂性、制造工艺以及证明相似性以获得批准所需的数据方面与仿制药不同。表 1. FDA 批准的适应症:
HIM.PA.SP60 生物和非生物 DMARD
修订日志请参阅本政策末尾的重要提醒,了解重要的监管和法律信息。描述以下是需要事先授权的生物学和非生物学疾病改良的抗毛药(DMARD):tocilizumab(actemra®),adalimumab(humira®),adalimimAb-abab-afzb(abrilada™) P(Hulio®),Adalimumab-Adaz(Hyrimoz®),Adalimumab-aacf(idacio®),adalimumab-ryvk(ymlandi®b-a),adalimumab ry™),英澳,secukinumab(cosentyx®),eTanercept(enbrel®),vedolizumab(entyasstekinizum®mab-srlf(imuldosa™),infrifiximab-dyyb(fiffectra® Ab-Mrkz(Omvohteil®),Umab-aauz(Otulfi®),Ustekinumab-ttwe(Pyzchiva®),英夫利昔单抗(Remicade®),英夫利克斯莫比(Remicade®) N(Simponi®,SimponiAria®),risankizumab-rzaa(Skyrizi®),Deucravacitinib(Sotyktu™),uStekinumab(stelara®),ustekinumab-stba(seqeyma®®®)® ®),Natalizumab-sztn(Tyruko®),Natalizumab(Tysabri®),Etrasimod(Velsipity™),Ustekinumab-auub(Wezlana™),Tofacitinib-rjankinib-rjank®U®,Xeljanz™),Xeljanz™),OzAniMod(Zepos)(Zepos)(Zepos)。 FDA 批准适应症
高剂量英夫利昔单抗相关脑静脉窦血栓形成:病例报告及文献综述
炎症性肠病 (IBD) 主要指溃疡性结肠炎 (UC) 和克罗恩病 (CD)。其发病率逐年上升,好发于 20 至 30 岁的女性。由于症状严重,血栓形成是 IBD 患者的主要不良事件 (1, 2)。一项对 13,756 名 IBD 患者的队列研究显示,与对照组相比,IBD 患者的静脉血栓栓塞症总体风险比为 3.4 (3)。该比率在发作期 [8.4] 和慢性活动期 [6.5] 较高,但在缓解期 [2.1] 较低。据报道,UC 患者比 CD 患者更容易发生脑梗塞 (4)。脑梗塞也被认为是 IBD 患者并发症的原因 (5)。Katsanos 等人于 2014 年进行了一项文献综述。 33 例 IBD 患者中报告了 15 例动脉脑血栓栓塞并发症病例(6)。关于 IBD 患者脑静脉血栓形成,在一系列研究中还发现,9 例脑梗塞病例中有 7 例是由于窦血栓形成引起的(8)。英夫利昔单抗(IFX)是一种有效的抗肿瘤坏死因子(TNF)抗体,对 IBD 患者非常有效(8, 9)。它是